ראשי פרקים
1. הקדמה
2. פרמקוקינטיקה
3. פרמקודינמיקה
4. איכות מקורות המידע
5. סיכום ומסקנות
6. פרק בונוס - סובייקטיביות בפירוש הנתונים
7. נספח מושגי יסוד
8. נספח סוגי מחקרים
9. מקורות
ניתן גם להדפיס או להוריד כקובץ, כאן >
1. הקדמה
ככל שמתרחב השימוש העולמי בצמחי מרפא לצד טיפולים תרופתיים קונבנציונליים, גדל מספר המחקרים, הפרסומים ודיווחי המקרה העוסקים בנושא התגובות ההדדיות ביניהם.
למעשה, שטף המידע בנושא גורם לבלבול רב בקרב חולים, מטפלים ורופאים כאחד, שכן לצד תגובות הדדיות שליליות אפשריות בעלות פוטנציאל נזק ממשי, אשר מטבע הדברים גורמות לחששות רבים, קיימות גם לא מעט תגובות הדדיות חיוביות אשר עשויות לשפר את הטיפול התרופתי, להפחית מתופעות הלוואי שלו ולהעלות את איכות החיים של המטופלים.
מטרת המאמר היא לתת לקוראים את הכלים הנכונים אשר יאפשרו הערכה ביקורתית ומושכלת של המחקרים בנושא והספרות הרפואית הנרחבת ובעיקר הבנה מתי כדאי לשלב צמחי מרפא עם תרופות, מתי אסור לעשות כן ומתי ניתן לשלב אך יש לנקוט זהירות בשילוב.
על מנת לדעת "להפריד את המוץ מהתבן", יש להבין את המנגנונים שביסוד ההשפעות ההדדיות בין צמחי מרפא ובין תרופות, את ההבדלים בין סוגי המחקרים השונים ואת המשמעות הקלינית של הידע המצטבר.
בנוסף, לא פעם יש שונות רבה בממצאי המחקרים, ולעתים דיווחים המתקבלים מסוג אחד של מחקרים סותרים דיווחים המתקבלים מסוג אחר. המשמעות האמיתית של נתוני מחקרים סותרים, או שאינם מהימנים דיים, נגזרת למעשה מהפרשנות של הממצאים. לכן, נקדיש פרק מיוחד לאופן פירוש הנתונים על ידי גורמים מקצועיים ויישום המידע בפרקטיקה הקלינית.
מומלץ (בחום), לפני קריאת המאמר, לעבור על נספח מושגי היסוד אשר מסביר ומרחיב את המושגים הנדונים במאמר.
2. פרמקוקינטיקה
ספיגה | פירוק | פיזור | הפרשה | סיכום
פרמקוקינטיקה עוסקת בתהליכים שעוברים חומרים פעילים מרגע כניסתם לגוף, דרך פירוקם והגעתם לאברי המטרה ועד להפרשתם מן הגוף. בחומרים פעילים לרוב אנו מתכוונים לתרופות, אך גם צמחים ורכיבי מזון נכללים בהגדרה זו. בשפה עממית ניתן לתאר פרמקוקינטיקה כ"מה הגוף עושה לתרופה". נהוג לחלק את המעבר של תרופות בגוף לארבעה שלבים: ספיגה, פירוק, פיזור והפרשה. צמחי מרפא עשויים להשפיע על כל אחד מן השלבים ובכך להשפיע על חילוף חומרים של תרופות.
ספיגה
ספיגה מתייחסת למעבר חומרים דרך דופן המעי אל מחזור הדם ואל הכבד. צמחי מרפא עשויים להשפיע על ספיגת תרופות בכמה מנגנונים:
ראשית, נטילה בו-זמנית של צמחי מרפא ותרופות עלולה ליצור חיבור בין רכיבים שונים או הפחתה במסיסות ולפגוע בספיגה, הן של הצמחים והן של התרופות(1). הכוונה בעיקר לצמחים המכילים סיבים מסיסים(1), גומי וצמחים ריריים (מוצילגנים) כגון ג'ל/מיץ אלוורה (Aloe spp), זרעי פשתן, נטופית רפואית (Althea officinale), זרעי פסיליום (Plantago psyllium) וריבס (Rheum officinale).
שנית, צמחי מרפא, בעיקר בהכנות מימיות (חליטות ומרתחים) עלולים להפחית את חומציות הקיבה. ברוב המקרים רמת החומציות של המיצויים המימיים נעה בין 4 ל-6, אך יש מיצויים עם pH נמוך מ-3 וגבוה מ-7(2).
בנוסף, צמחי מרפא שונים עשויים להשפיע על זרימת הדם למעי. נטילת ג׳ינג׳ר למשל, מגבירה את הזמינות הביולוגית ואת קצב ספיגתן של תרופות שונות(3-5), בין היתר על ידי הגברת זרימת הדם למעי(6) על ידי החומר הפעיל (shogaol).
במקרים נדירים, צמחי מרפא אף עשויים להשפיע על הפרשת הורמונים שונים במערכת העיכול המשפיעים על קצב ריקון הקיבה או תנועתיות המעי. כך למשל, תכשיר צמחי יפני מסורתי הגביר את הפרשת הורמון הרעב גרלין המעכב את קצב ריקון הקיבה(7-9) ואילו במחקר אחר(10) דווח על תכשיר צמחי סיני מסורתי המעלה את ריכוז הפפטיד motilin המשפיע על תנועתיות השריר החלק במעי.
לבסוף, צמחים המשפיעים על תנועתיות המעי משפיעים למעשה על משך השהות של תרופות בדרכי העיכול(11). ככל שתרופות שוהות זמן רב יותר במעי כך הן זמינות יותר לספיגה. לפיכך, צמחים משלשלים המעודדים את תנועתיות המעי (Aloe spp.,Cassia senna, Rhamnus purshiana, Rheum officinale) וצמחים עתירי סיבים (גואר-גאם, פסיליום) הסופחים את חומצות המרה ומעודדים את הפרשתן מן הגוף עשויים לקצר את זמן השהות של התרופות במעי ולהפחית את ספיגתן(11,12).
על פי רוב, ניתן למנוע את הפרעות הספיגה שתוארו לעיל על ידי הפרדה של שעתיים בין נטילת צמחי המרפא לנטילת התרופות(13). הפרדה זו תנטרל לא רק את ההשפעות על הספיגה אלא אף חלק מן ההשפעות הנובעות מהתערבות במנגנון P-pg ובפעילות אנזימי התובלה המתוארים בהמשך.
המנגנון העיקרי המשפיע הן על זמינותן של תרופות לפירוק במעי ובכבד והן על ספיגתן בתאי המטרה הוא מנגנון P-gp או גליקופרוטאין P. זוהי משאבה חלבונית המסלקת את התרופה הנספגת אל התא חזרה אל החלל הבין תאי. לקריאה נוספת על משאבת P-gp - לחץ כאן.
מנגנון P-gp נפוץ מאוד באפיתל המעי, בתאי הכבד, ובתאי הצינורית המקורבת של הכליה ותפקידו לשאוב החוצה מהתאים חומרים פעילים שונים (כגון רעלים ותרופות) אל חלל המעי, אל צינורות המרה ואל צינוריות ייצור השתן בהתאמה לשם הפרשתם מהגוף.
למעשה, למנגנון P-gp השפעה הן על ספיגת תרופות (חלבוני P-gp המצויים במעיים ובכבד) המפורטת להלן והן על פיזורן בגוף (חלבוני P-gp המצויים בשאר התאים), השפעה המפורטת תחת סעיף פיזור.
במקרה הפרטי של תאי המעי, עיכוב המנגנון יגביר את הספיגה דרך המעיים לדם ויעלה את החשיפה הסיסטמית של הגוף לתרופה הנספגת. לדוגמא, במחקר קליני(14) נטילת 600 מ״ג תמצית שכיזנדרה למשך 14 ימים, עיכבה את פעילות מנגנון P-gp במעיים והגבירה במידה מובהקת את החשיפה הסיסטמית של התרופה Talinolol (ממשפחת חסמי הבטא).
גורמים נוספים המשפיעים על ספיגת התרופות הם אנזימי תובלה (הנשאים OATP) המכניסים תרופות מחלל המעי לתאי המעי ולתאי הכבד ומשפיעים אף הם על הזמינות הביולוגית שלהן.
מספר דוגמאות: במחקר קליני(15) נטילת מיצוי baicalin במינון 1500 מ"ג ליום במשך שבועיים הפחיתה את החשיפה הסיסטמית של התרופה Rosuvastatin (הריכוז המקסימלי בדם והריכוז כפונקציה של זמן) דרך צמצום סלקטיבי של פעילות אנזימי התובלה OATP1B1. במחקר מעבדה(16), נמצא שגינקו דו אונתי מעכב באופן משמעותי את אנזימי התובלה OATP-B ועלול להשפיע על ספיגת תרופות מהמעי. במחקר מעבדה אחר(17), נמצא כי רכיבים פעילים שבודדו מצמחים שונים (Mulberrin, Scutellarin, Quercetin, Glycyrrherinic acid) הדגימו עיכוב חזק של הנשא OATP2B1 ועיכבו קישור של תרופות ממשפחת הסטטינים (Atrovastatin, Fluvastatin, Rosuvastatin) לנשא זה.
חשוב לציין כי למעט המחקר היחיד שהזכרנו לעיל, רוב העדויות הקיימות בספרות לגבי השפעה על אנזימי תובלה הן של רכיבים צמחיים מבודדים ולא מיצויים מצמחים שלמים. רכיבים מבודדים הנבדקים במעבדה נבחנים לרוב במינון גבוה בהרבה ממינונם בגוף לאחר ספיגה ופירוק של הצמח השלם. לא ברור אם אכן מתקבלת השפעה משמעותית של אותם רכיבים בנטילת הצמחים השלמים.
פירוק
הפירוק העיקרי של חומרים הנכנסים אל הגוף מתבצע בכבד על ידי מגנון המכונה ציטוכרוֹם CYP450. זהו מבנה חלבוני מורכב המשמש למעשה כ"מסננת" של הגוף ומופעל על ידי אנזימים שונים המצויים בדופן המעי ובכבד. חלק מאנזימי הציטוכרוֹם (CYP3X, 2X, 1X) מעורבים בפירוק והפעלה של תרכובות שאנו צורכים (ביניהן תרופות וצמחים), ואילו אנזימי ציטוכרוֹם אחרים מעורבים ביצירה ובפינוי של תרכובות אנדוגניות כמו הורמונים, חומצות מרה וחומצות שומן(18,19). עליהם נרחיב תחת סעיף הפרשה.
האנזימים החשובים ביותר בתהליך חילוף החומרים התרופתי(20) הם CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1, CYP3A4 ו-CYP3A5.
חלק מצמחי מרפא, כמו חומרים רבים אחרים, עשויים להשפיע על פעולת אנזימי הציטוכרוֹם(1) באחד משני אופנים:
עיכוב פעילות אנזימטית - עיכוב הביטוי הגנטי ו/או פעולת אנזימי הציטוכרוֹם (לרוב מדובר בעיכוב הפיך). פירוש הדבר שפירוק התרופה יתעכב וריכוז התרופה בדם יעלה. כך למשל, מחקרים רבים(21) מראים השפעה מעכבת משמעותית של שום על אנזים CYP2E1, בייחוד באוכלוסיה מבוגרת(22,23). דוגמא נוספת, שאינה מתחום צמחי המרפא אך רלוונטית לא פחות, היא עיכוב משמעותי ובלתי הפיך של אנזימי CYP3A4 על ידי צריכת מיץ אשכוליות, אשר הודגמה בשלל מחקרים. השפעה זו של מיץ האשכוליות עלולה לגרום לתגובה הדדית עם לא פחות מ-85 תרופות שונות(24).
עיכוב פעילות האנזימים הוא תהליך מהיר יחסית אשר עלול להוביל לרעילות תרופתית בתוך יומיים-שלושה.
הגברת פעילות אנזימטית - הגברה של פעולת אנזימי הציטוכרוֹם וכתוצאה, הפחתה של ריכוז התרופה בדם. כך למשל, במחקר קליני(25) נמצא שצריכת כורכומין, במינון של 1 גרם ליום במשך 14 ימים, הגבירה את פעילותו של האנזים CYP2A6 ב-48.9%.
במחקרים קליניים אחרים(26,27), נמצא שצריכת 300 מ"ג גליצריזין ביום (שווה ערך ל-2-15 גרם צמח שלם) למשך שבועיים הגבירה בצורה מתונה את פעילותו של האנזים CYP3A4 והפחיתה את החשיפה הסיסטמית של מספר תרופות בכ-20%.
גם במקרה זה, מרבית העדויות בספרות קיימות לגבי רכיבים צמחיים מבודדים ולא מיצויי צמחים שלמים, למעט המקרה של פרע מחורר (Hypericum perforatum) אשר מגביר באופן גורף ומשמעותי את פעולת אנזימי הציטוכרוֹם, וכתוצאה גורם לירידה של רמת תרופות בדם. בהמשך המאמר תמצאו הרחבה על השפּעתו של הפרע על חילוף החומרים התרופתי.
הגברת פעילות האנזימים היא תהליך איטי שאורך מספר ימים ואף שבועות.
פיזור
פיזור מתייחס להגעת חומרים פעילים של צמחים ותרופות אל איברי המטרה ולספיגתם בתאי הרקמה הרלוונטית. צמחי מרפא עשויים להשפיע על קשירת תרופות לחלבוני תובלה בפלסמה (כגון הנשא אלבומין), או להגביר את הביטוי הגנטי של חלבוני התובלה בפלסמה.
ברם אולם, אפשרויות אלו הנן תאורטיות בעיקרן וחסרות ביסוס מחקרי קליני. קיימת עדות בודדת ממחקר מעבדה(28) בו הודגמה תחרות על קישור לנשא אלבומין, בין הרכיב הצמחי TanshinonIIA מהצמח מרווה סינית (Salvia miltiorrhiza) ובין התרופה Warfarin.
לעומת זאת, כן קיימת השפעה של צמחי מרפא על הספיגה התאית של החומרים הפעילים, וזאת דרך התערבות במנגנון P-gp המשמש כ-וסת לחדירות חומרים שונים לתאים. עיכוב המנגנון יגביר את חדירות התרופות לתוך התאים, בעוד הגברת פעילות המנגנון תביא לירידה ברמת התרופה בתאים.
במחקרי מעבדה, רכיבים פעילים של צמחים רבים (פיפרין(29), ג'ינסנוסיידים(30,31), סילימרין ופלבונואידים נוספים המופקים מגדילן(32), קפסאיצין(33) ורזברטרול(33) הדגימו עיכוב של מנגנון P-gp והגברת חדירות של תרופות לתאים. בנוסף, כורכומין(34) וכורכומינואידים(35), כמו גם קטכינים שהופקו מתה ירוק(36-38) הפחיתו בתנאי מעבדה את הביטוי הגנטי ואת הפעילות של מנגנון P-gp.
יתרה מזאת, כמה מהרכיבים הצמחיים הללו (כגון פיפרין וסילימרין) משפיעים על מנגנון P-gp גם במינונים הנצרכים בתזונה, ומכאן שהסיכוי להשפעה הדדית עם תרופות דרך השפעה על מנגנון זה בגוף החי גבוה(29,32). כמו כן, נמצא שמיץ אשכוליות ומיץ תפוזים חוסמים את פעילות P-gp וכתוצאה מכך הודגמה תגובה הדדית עם תרופות שונות(39-42).
הפרשה
השפעה נוספת של צמחי מרפא על חילוף חומרים תרופתי היא על תהליכי הסילוק וההפרשה של התרופות מן הגוף. צמחי מרפא עשויים להשפיע על תהליכי הפרשה המתרחשים בכבד, על נשאים שונים או על תפקוד הכליות.
השפעה על הכבד - מלבד ההשפעות על אנזימי ציטוכרוֹם P450 אשר תוארו תחת סעיף הפירוק, ואשר נחשבים כאנזימי "הפאזה הראשונה", צמחי מרפא משפיעים גם על אנזימים הפועלים ב"פאזה השנייה". בשלב זה פועלים אנזימי כבד על מנת לנטרל את תוצרי הביניים הרעילים של התרופות שפורקו ועל מנת להכינם להפרשה מן הגוף דרך נוזלי המרה והשתן(11). בין האנזימים הללו נכללים glutathione S-tranferase (GST), N-acetyl tranferase (NAT), sulfotranferase (ST) ו- (uridine diphosphoglucuronosyl transferase (UGT.
ההשפעות על האנזימים המוזכרים לעיל יכולות להיות חיוביות או שליליות, כתלות בהגברת פעילות האנזימים או עיכובה, בהתאמה.
כך למשל, במספר מחקרים שנערכו בבעלי חיים, תמציות של זרעי סרפד(43) צורב (Urtica urens), שילוב של גדילן (Silybum marianum) ושורש שינן רפואי(Rad. Taraxacum officinalis) (44) וכורכומין שמוצה מכורכום(Curcuma longa) (45), הגבירו את פעילות האנזים GST בכבד ובכליות והפחיתו עקה חמצונית.
לעומת זאת, קיימות עדויות ממחקרי מעבדה(46,47) כי צמחי מרפא כגון ולריאן רפואי (Valeriana officinalis) או גינקו דו-אונתי (Ginkgo biloba) ובעיקר רכיבים מבודדים (schisantherin-A, baicalin, wogonin) עשויים(48,49) לעכב את אנזימי UGT.
עיכוב זה עלול להגביר את רעילות התרופות שאמורות להתפרק דרך אנזים זה, אולם לא קיימות עדויות קליניות להשפעות משמעותיות עקב שילוב צמחי מרפא ותרופות המנוטרלות דרך אנזימי UGT.
השפעה על נשאים - קיימת משפחה של נשאים המכונה Solute carrier 22 וכוללת נשאי קטיונים (OCT) ואניונים (OAT). השפעה על פעולת הנשאים עשויה להתערב בהפרשה האקטיבית של חומרים. השפעה זו מתרחשת בעיקר בכליות, למרות שהנשאים המוזכרים מצויים גם בכבד.
כך למשל, הצמח סאתרלנדיה (Sutherlandia frutescens) הנפוץ בדרום אפריקה כטיפול עממי ב-HIV עיכב את פעילות נשאי האניונים OATP1B1,1Bִ3 במעבדה לצד עיכוב P-gp וצמצם את פינוי התרופה midazolam מהתאים ב-40%(50).
דוגמא נוספת, תמצית תקנית של מיני בטטת בר (DA-9801) שנבחנה(51) כטיפול אפשרי בנפרופתיה סוּכרתית עיכבה במעבדה את פעילות נשאי הקטיונים OCT1, OCT2 ואת פעילות נשאי האניונים OAT3 ו-OATP1B1. חשוב לציין כי לא כל השפעה על נשאים תביא לתגובה קלינית ממשית. עיכוב הנשאים על ידי בטטת בר, שהובא כדוגמא לעיל, לא השפיע על פינוי התרופה Cimetidine בחולדות גם כשהתמצית ניתנה במינון גבוה (1000 מ"ג/ק"ג במתן פומי).
השפעה על הכליות - תגובות הדדיות בין צמחים ובין תרופות יכולות גם לנבוע מהתערבות בתפקודים הכלייתיים. ה"חשודים" העיקריים הם צמחי מרפא הידועים בפעילותם המשתנת, כגון עלי שינן (Folia Taraxacum officinalis), עלי פטרוזיליה (Petroselinum crispum), זרעי סלרי (Apium graveolens), סרפד (Urtica dioica), זקן תירס (Zea mays), חותם הזהב (Hydrastis canadensis), ענבי דוב (Arctostaphylos uva-ursi) וכד' אשר עשויים תאורטית להגביר את קצב הפינוי של תרופות, אך פעולתם לרוב עדינה והם אינם משפיעים על פינוי התרופות מהדם(11).
בנוסף, קיימים צמחי מרפא אשר עשויים להשפיע על תפקוד הכליות במנגנונים אחרים. הצמח ריבס (Rheum officinale) עלול להחמיר יצירת אבנים בכליות בשל תכולת החומצה האוקסלית הגבוהה שבו ולגרום בשל כך להפרעה בתפקוד הכלייתי(52).
במקרים אחרים, צמחי מרפא עשויים דווקא לשפר את תפקוד הכליות ולהגן עליהן מפני רעילות הנגרמת על ידי תרופות שונות. כך למשל, במחקר שנערך בעכברים(53) נמצא שפטריית הריישי (Ganoderma lucidum) הפחיתה באופן משמעותי את הרעילות הכלייתית שנגרמת על ידי התרופה cisplatin.
סיכום תגובות הדדיות פרמקוקינטיות של צמחי מרפא ותרופות
צמחי מרפא מסוימים משפיעים על ספיגה של תרופות, על זמינותן הביולוגית, החשיפה הסיסטמית אליהן ועל קצב הפינוי שלהן מהדם(54-56).
יחד עם זאת, תגובות הדדיות פרמקוקינטיות משמעותיות מבחינה קלינית מוגבלות ברובן למספר מצומצם של צמחי מרפא, ביניהם פרע מחורר (Hypericum perforatum), גינקו דו-אונתי (Ginkgo biloba), שוש קירח (Glycyrrhiza glabra), ג'ינג'ר (Zingiber officinale) שום (Allium sativum) ומיני ג'ינסנג (Panax ginseng, Panax quinquefolium).
גם בקרב צמחי מרפא אלו, "המועדים לפורענות", התגובות ההדדיות הן בדרך כלל פרטניות ומשמעותן הקלינית מבודדת לתרופות מסוימות. לעתים, נטרול של רכיב פעיל מסוים יגרום להפחתה משמעותית בכמות התגובות ההדדיות של אותו הצמח.
להלן מספר דוגמאות:
שום (Allium sativum) מגביר את פעילותו של האנזים CYP3A4, אולם השפעה זו היא מתונה בדרך כלל ובעלת משמעות קלינית רלוונטית רק לשילוב עם תרופות אנטי ויראליות (מעכבי פרוטאזות) אשר משמשות לטיפול בכשל חיסוני נרכש(57).
דוגמא נוספת ומעניינת היא המקרה של גינקו דו אונתי (Ginkgo biloba).
מצד אחד, גינקו מעכב את פעילות האנזים CYP3A וכתוצאה מגביר את הריכוז בדם של מספר תרופות, ביניהן Nifedipine (ממשפחת חוסמי תעלות סִידן)(58), Diliazem (חוסמי תעלות סִידן)(59), ו-Pioglitazone (תרופה להורדת סוכר)(60). בחלק מן המקרים אף נצפתה הגברה של תופעות הלוואי התרופתיות.
מצד שני, גינקו מגביר את פעילות האנזימים CYP3A2 ו-CYP2B וגורם להפחתה בריכוז בדם וביעילות של התרופות Nicardipine (ממשפחת חוסמי תעלות סִידן)(61) ו-Phenobarbital (תרופת הרדמה)(62) בהתאמה.
יוצא דופן הוא המקרה של פרע מחורר (Hypericum perforatum), צמח המשפיע באופן גורף ומשמעותי על מספר מנגנונים וכתוצאה גורם לירידה ברמות של תרופות רבות בדם.
פרע מחורר מגביר באופן משמעותי את פעילות האנזים CYP3A4 ואת פעילות מנגנון P-gp המצוי במעיים.
כתוצאה, רמתן בדם של תרופות רבות יורדת, עד כדי פגיעה משמעותית בפעילותן הרפואית.
כך למשל, הגברת פעילות מנגנון P-gp גורמת לירידה משמעותית (18-27%) ברמת התרופה דיגוקסין בדם(63,64). השפּעתו של הפרע על אנזים CYP3A4 גורמת לירידה ברמתם של חומרי הרדמה, תרופות כנגד דחיית איברים מושתלים, כימותרפיה, חוסמי תעלות סִידן, גלולות נגד הריון ועוד תרופות רבות אחרות(65).
במקרה של פרע מחורר, קיים רכיב פעיל יחיד האחראי לרוב ההשפעות הפרמקוקינטיות של הצמח, היפרפורין שמו. קיימת תמצית של הצמח דלה ברכיב זה, המשווקת גם כתרופת מרשם בשם Remotiv, אשר שימוש בה מונע את רוב התגובות ההדדיות של הפרע עם תרופות(66).
תגובות הדדיות פרמקוקינטיות עשויות במקרים מסוימים להיות גם חיוביות.
כך למשל, לתרופה נוגדת הקרישה Cidogrel עשויה להיות עמידות בקרב חלק מהאוכלוסיה הנובעת מביטוי גנטי של פנוטיפ. בניגוד להפחתת הפעילות של תרופות נוגדות קרישה אחרות, שילוב של פרע מחורר עם תרופה זו יכול להעצים את השפּעת התרופה. במחקרים קליניים נמצא שבקרב נבדקים בעלי עמידות לתרופה, שילובה עם 900 מ״ג ליום תמצית מתוקננת של פרע מחורר הביא לעליה של כ- 10%-20% בעיכוב טסיות הדם(67,68).
דוגמא פוטנציאלית נוספת היא עיכוב של מנגנון P-gp הנפוץ גם בתאים סרטניים שם הוא משמש את התא הסרטני כמנגנון הגנה אשר מווסת את זרימת התרופות (רעלים) לתוך ומחוץ לתא. כך נוצרת עמידות לתרופות כימותרפיות שונות.
הצמח מלון מר (Momordica charantia) מעכב את המנגנון וגורם להפחתת עמידות תאי סרטן לתרופות. במספר מחקרים אשר נערכו בתנאי מעבדה, על תאי סרטן מסוגים שונים (מעי גס, לבלב, שחלות ועוד), מיצוי של מלון מר הפחית עמידות והגביר זמינות תרופות כימותרפיות שונות, ביניהן Doxorubicin, Cisplatin, Paclitaxeln ו-Gemcitabine, באופן תלוי מינון. אמנם פעילות זו טרם הודגמה במחקרים קליניים אולם הפוטנציאל החיובי הנו משמעותי(69-72).
מלון מר אינו לבד. במחקרי מעבדה שנערכו על רוזמרין(Rosmarinus officinalis) (73), ג׳ינסנג סיבירי(Eleutherococcus senticosus) (74), קערורית סינית (Scutellaria baicalensis) (75) וכשותנית(Humulus lupulus) (76) הודגמו השפעות מעכבות על מנגנון P-gp ומנגנונים נוספים (BCRP, MRP) הגורמים עמידות לתרופות כימותרפיות.
תחום שכמעט לא נחקר אך חשוב לא פחות עוסק בהשפעה הפרמקוקינטית של התרופות השונות על חילוף החומרים של רכיבים צמחיים. לדוגמא, חיידקי המעי ממלאים תפקיד מרכזי בפירוק ובספיגה של גליקוזידים. אנטיביוטיקה בנטילה פומית עלולה להשפיע בצורה מכרעת על פרמקוקינטיקה של רכיבים גליקוזידיים בצמחים(77).
חשוב לציין כי מחקרי מעבדה הבודקים תגובות פרמקוקינטיות אינם מנבאים תמיד את התגובות אשר אכן מתרחשות בסיטואציה קלינית. הרחבה על הנושא בפרק מקורות מידע.
3. פרמקודינמיקה
השפעה מצטברת | השפעה מנוגדת
פרמקודינמיקה עוסקת בהשפעה הרפואית של תרופות וצמחי מרפא על איברי המטרה בגוף.
בשפה עממית ניתן לתאר פרמקודינמיקה כ "מה התרופה עושה לגוף".
לצמחי מרפא ולתרופות עשויות להיות השפעות דומות (סינרגיסטיות) על הגוף, למשל תרופה משתנת יחד עם צמחי מרפא משתנים או השפעות מנוגדות (אנטגוניסטיות) על הגוף, למשל תרופה מרגיעה יחד עם צמחי מרפא הממריצים את מערכת העצבים.
בפרק זה נרחיב מעט על סוגי ההשפעות ועל משמעותן הקלינית.
השפעה מצטברת
שילוב צמחי מרפא ותרופות בעלי פעילות רפואית דומה עלול לגרום השפעה חזקה מדי ואף רעילה.
לדוגמא, שילוב צמחי מרפא נוגדי קרישה כגון מרווה סינית (Salvia miltiorrhiza), גינקו דו אונתי (Ginkgo biloba), ג'ינסנג (Panax ginseng), ג'ינג'ר (Zingiber officinale) ושום (Allium sativum) יחד עם תרופות נוגדות קרישה כגון קומדין עלול לגרום דימומים מוגברים ואף להוביל לסכנת חיים. צמחי המרפא הנ"ל, אם באמצעות עיכוב של האנזים אפוקסיד רדוקטאז המפריע למטבוליזם של ויטמין K, או באמצעות השפעות נוספות על מנגנון הקרישה, גורמים להפחתת קרישיות הדם בדיוק כשם שעושה התרופה קומדין(79).
דוגמא נוספת, שילוב של פרע מחורר (Hypericum perforatum) עם תרופות נוגדות דיכאון אחרות, ובעיקר מעכבי ספיגה חוזרת של סרוטונין (כדוגמת Seraline, Nefazodone) עלול לגרום לתסמונת סרוטונין בנבדקים קשישים(80).
לעתים, השפעה מצטברת היא שולית לפעילות הרפואית אך בעלת משמעות קלינית.
כך למשל, צריכת מינון גבוה של שוש קירח (Glycyrrhiza glabra) עלולה(81) להגביר את איבוד האשלגן הנגרם על ידי תרופות שונות (משתני לולאה, תיאזידים, משלשלים), וכתוצאה לשבש את פעולתן של תרופות להסדרת קצב לב (דיגוקסין) ולסתור את פעולתן של תרופות להורדת לחץ דם (מעכבי ACE).
ההשפעות שתוארו לעיל הנן שליליות בעיקרן, אולם השפעה מצטברת עשויה להביא גם לתוצאות חיוביות.
למשל, לכורכומין, הרכיב הפעיל של הכורכום, פעילות נוגדת דלקת משמעותית.
במספר מחקרים קליניים הודגם כי שילוב כורכומין הגביר את ההשפעה התרופתית של תרופות נוגדות דלקת (תרופות מסוג 5-ASA, NSAID's וסטרואידים) והביא לתוצאות קליניות טובות יותר בקרב חולים במחלות מעי דלקתיות(82,83). יתרה מכך, שילוב כורכום עם תרופות מסוימות (Diclofenac, Acetaminophen,5-asa, Fasalazine, Prednisone, Azathioprine אוBudesonide) במחלות מעי דלקתיות ובדלקת מפרקים שגרונית הביא לצמצום תופעות הלוואי התרופתיות או אף להפחתת המינון התרופתי ללא פגיעה ביעילות הטיפול(84,85).
דוגמא נוספת היא שילוב מושכל של תרופות עם צמח המרפא ג׳ימנמה (Gymnema sylvestre), המשפיע על רמת הסוכר בדם במספר מנגנונים. בשני מחקרים קליניים, שילוב ג'ימנמה יחד עם תרופות להורדת סוכר, הן בקרב חולי סוכרת סוג 1 והן בקרב חולי סוכרת סוג 2, הביא לתוצאות קליניות משופרות(86) ואף להפחתה במינון התרופתי הנדרש(87).
ודוגמא אחרונה בסעיף זה, לשילוב גינקו דו אונתי עם תרופות, שהוזכר קודם בהקשרים של תגובות שליליות, גם צדדים חיוביים.
בסקירה של מחקרים קליניים נמצא כי שימוש בגינקו במינון של 60-450 מ"ג ליום, במשך 24 שבועות, כטיפול תומך לטיפול תרופתי קונבנציונלי באלצהיימר, היה יעיל יותר לשיפור התפקוד הקוגניטיבי והתפקוד הכללי בהשוואה לטיפול הקונבנציונלי לבדו(88).
השפעה מנוגדת
לחלק מצמחי המרפא פעילות רפואית אשר עלולה להיות מנוגדת לפעילות רפואית של תרופה ולגרום להפחתה ביעילות התרופה או להוביל לכשל טיפולי.
כך למשל לא רצוי לשלב צמחים מחזקי חיסון כגון אנדרוגרפיס (Andrographis paniculata), אסטרגלוס (Astragalus membranaceus), רודיולה (Rhodiola rosea) או אכינצאה (.Echinacea spp) עם תרופות לדיכוי חיסוני(89).
דוגמא נוספת לתגובה שלילית בשל השפעה מנוגדת היא שילוב של צמחים ממריצים, אשר עשויים להעלות את לחץ הדם יחד עם תרופות להורדת לחץ דם(90-91). מדובר בצמחים כגון קפסיקום (Capsicum spp), אפדרה (Ephedra sinica), רוזמרין (Rosmarinus officinalis), גווארנה (Paullinia cupana), שוש קירח (Glycyrrhiza glabra), חותם הזהב (Hydrastis canadensis).
מצד שני, צמחי מרפא עשויים לנטרל תגובות תרופתיות שליליות. הנה מספר דוגמאות:
נטילה משולבת של שוש קירח יחד עם תרופות נוגדות דלקת ממשפחת ה-NSAID's עשויה לצמצם באופן משמעותי את שיעור הדימומים והכיבים בדרכי העיכול הנגרמים כתופעות לוואי משימוש בתרופות אלו(92-95).
שילוב גינקו דו אונתי (Ginkgo biloba) עם התרופה הכימותרפית Doxorubicin מפחית בצורה משמעותית את הרעילות הלבבית שנגרמה מהתרופה (שיעור של 6% חריגה בבדיקות ECG, לעומת 30% בקבוצת הביקורת, שנטלה את התרופה בלבד)(96).
למעשה צמחים רבים עשויים לנטרל רעילות של תרופות כימותרפיות.
שילוב של וויתניה משכרת (Withania somnifera) עם משלב התרופות(97) CEF (הידועות בשם: Cyclophosphamide, Epirubicin ו-Fluorouracil) ו- TAC (הידועות בשם: Cyclophosphamide, Adriamycin ו-Taxotere) וג׳ינסנג אמריקאי (Panax quinquefolium) עם טיפולי כימותרפיה והקרנות(98), קוהוש שחור (Cimicifuga racemosa) עם טמוקסיפן(99) ופטריית ריישי (Ganoderma lucidum) עם דוקסורוביצין וציקלופוֹספמיד(100). כל אלו (כל אחד בנפרד) נבדקו במחקרים קליניים והדגימו צמצום משמעותי של תופעות לוואי חמורות הנגרמות עקב הטיפולים הכימותרפיים.
ואחרון חביב, גדילן מצוי (Silybum marianum). לגדילן פעילות מגנה ומשקמת על הכבד. מחקרים קליניים רבים הדגימו כי נטילה משולבת עם תרופות אשר עלולות להיות רעילות לכבד מנטרלת השפעות שלילות אלו(101,102).
לעתים אנו עדים לתגובה הדדית אשר לא ברור אם מקורה בתגובה פרמקוקינטית או פרמקודינמית. שילוב תמצית מיטאקי (Grifola frondosa) עם תרופה להשריית ביוץ (Clomiphene citrate), בקרב נשים בעלות תסמונת שחלה פוליציסטית, הצליח להשרות ביוץ בקרב 87% מהמטופלות שלא חוו ביוץ באמצעות טיפול בודד (תרופה או תמצית מיטאקי)(103).
4. מקורות מידע
מחקרי הדמייה | מחקרי מעבדה | מחקרים בבע"ח | מחקרים בבני אדם | סיכום
עד עתה, כמעט כל הדוגמאות שהבאנו מקורן במחקרים קליניים מבוקרים בעלי משמעות קלינית ברורה. אבל זה כי בחרנו אותם "עם פינצטה".
מספר צמחי המרפא אשר נחקרו ביסודיות ובמחקרים קליניים מבוקרים רבים הוא זעום ולגבי מרבית הצמחים אנו נאלצים להסתפק בנקודת זמן זו במחקרים אשר נעשו בתנאי מעבדה או בקרב בעלי חיים.
לפיכך, פרק זה מוקדש לפערים הקיימים בין תוצאות המתקבלות בסוגי מחקרים שונים לבין משמעותן ב"עולם האמיתי" קרי בפרקטיקה הקלינית.
מומלץ למי שאינו בקיא בסוגי המחקרים השונים או בשיטות מחקר, לקרוא ראשית את נספח המחקרים הנמצא כאן.
מחקרי הדמייה (In silico)
מחקרי In silico בוחנים אפשרויות תאורטיות לתגובות הדדיות ואינם עומדים בפני עצמם משום שאינם מעמידים את התאוריה לבחינה במציאות, לפיכך יש לראות בהם בסיס בלבד למחקרים פרה-קליניים וקליניים נוספים. עם זאת, במציאות הנוכחית שבה רב הלא ידוע על הידוע בתחום השפעות רכיבים צמחיים על מנגנונים מטבוליים בגוף, מחקרי In silico יכולים לסייע במתן תעדוף לכיווני מחקרים במעבדה ובקליניקה. כך לדוגמא, מחקר In silico בחן את אפשרות הקשירה של רכיבים פעילים שונים בצמח מרווה סינית (Salvia miltiorrhiza) לנשא אלבומין. שמונה רכיבים פעילים של הצמח נמצאו כבעלי זיקה גבוהה לקולטן של החלבון הנשא. החוקרים(104) הציעו ממצא זה כהסבר להשפעה ההדדית של הצמח עם התרופה קומדין, המתבטאת בעליית ריכוז התרופה החופשית בפלסמה, והציעו להמשיך ולבדוק זאת במחקרי in vitro ו-in vivo.
מחקרי מעבדה (In vitro)
מחקרי מעבדה חיוניים להבנת המנגנונים שבבסיס ההשפעות ההדדיות בין צמחים ובין תרופות. עם זאת, באופן כללי ניתן לומר כי יש מתאם נמוך בין ממצאים במחקרי מעבדה לממצאים קליניים וכי תוצאות מחקרי מעבדה אינן יכולות לנבא תוצאות בקרב בני אדם.
להלן מספר דוגמאות:
בניגוד להשפעה המעכבת של מיצוי גינקו דו אונתי (Ginkgo biloba) על אנזים הציטוכרוֹם CYP2C9 שהודגמה במעבדה, לא נמצאה השפעה של מיצוי גינקו על אנזים זה ועל רמות סובסטרטים שלו בבעלי חיים(105).
למרות שבמחקרי מעבדה(106,107) פרע מחורר (Hypericum perforatum) הדגים עיכוב של אנזים הציטוכרוֹם CYP3A4, במחקרים קליניים הודגמה באופן חד משמעי הגברה של פעילות האנזים(108).
במחקרי מעבדה(106,109-111) נמצאה השפעה של גדילן (Silybum marianum) על מספר נתיבים אנזימטיים בציטוכרוֹם (CYP450). לעומת זאת, מחקרים קליניים(112-115) הראו כי לגדילן אין השפעה מהותית על רמה של תרופות בדם.
מחקרי בעלי חיים (In vivo)
מחקרי בעלי חיים חיוניים להבנת הקשר בין המנגנונים המטבוליים השונים ביצירת ההשפעות ההדדיות בין צמחים ובין תרופות בגוף החי(116). עם זאת, לבעלי חיים שונים מנגנונים ביולוגיים שונים מאלה של בני האדם. הבדלים אלה עשויים להיות כמותיים או איכותיים. דוגמא להבדל כמותי היא שונות בין בני אדם ובין כלבים ועכברים בזמינות הביולוגית של תרופות(117). שונות זו נובעת מהבדלים במסיסות החומרים, בחדירותם ובספיגתם כפועל יוצא של הבדלים בזמינות אנזימים במעי ובכבד.
נגזר מכך שלעתים קרובות ישנם הבדלים מהותיים בין בעלי חיים שונים ובין בני אדם במינוני הצמחים והתרופות הנדרשים כדי להדגים השפעה, והמינונים הנדרשים במחקרי בעלי חיים לא תמיד פרופורציונלים למינונים הנדרשים בקרב בני אדם. לדוגמא: במתן פומי של תמצית תקנית של גינקו דו אונתי (EGb) לחולדות (במינון 100 מ"ג לק"ג ליום) במשך ארבעה ימים הודגמה הגברת פעילות משמעותית של אנזימי הציטוכרוֹם השונים וחילוף חומרים תרופתי מוגבר כתוצאה מכך(118). עם זאת, במחקרים קליניים בבני אדם נתקבלה תמונה מורכבת: חלק מהמחקרים לא הדגימו השפעה על אנזימי הציטוכרוֹם(119-120), וחלקם הדגימו עיכוב של אנזימי הציטוכרוֹם השונים(121-122).
ישנם גם הבדלים איכותיים הנובעים משונות במסלולים מטבוליים בין בני אדם לבעלי החיים. לדוגמא: בני האדם מנטרלים פנולים לקראת פינויים מהגוף דרך שני מסלולים אנזימתיים:UGT ו-ST (אנזימי הפאזה השניה). לעומת זאת, בחתולים מסלול UGT לא קיים, ובחזירים מסלול ST לא קיים. בחולדות שני המסלולים קיימים אך יחס השימוש בהם שונה בהשוואה לבני אדם(117).
הבדל איכותי נוסף הוא שונות בדפוסי התפתחות מחלות. לדוגמא: נגיפי HIV משתכפלים לאט מאוד אצל שימפנזים בהשוואה לבני אדם(117). בתנאי מעבדה עולה גם קושי מתודולוגי לייצר מודל מחקרי המחקה בצורה מהימנה דפוסי מחלה אנושיים ולהעריך את התוצאות הנצפות של הטיפול באופן רלוונטי לבני האדם. לדוגמא: השריית חוסר אונים נרכש והתנהגות מיואשת במכרסמים כמודל לדיכאון בבני אדם.
לבסוף, מחקרי בעלי חיים רבים לוקים בבעיות תכנוניות, בהעדר בקרה מספקת ובמדגם מצומצם, ואינם עומדים בסטנדרטים המתודולוגיים של מחקרים קליניים בבני אדם(123).
מחקרים בבני אדם
דווחי מקרה | מחקרי עוקבה | מחקרים קליניים פתוחים | מחקרים אקראיים מבוקרים | סקירות שיטתיות ומטא אנליזות
מחקרים בבני אדם הם כאמור המקורות התקפים ביותר שיש בידינו לבחינת תגובות הדדיות בין צמחים ובין תרופות(116). אולם, לא כל המחקרים "נולדו שווים" וקיימים הבדלים באיכות ומהימנות מחקרים מסוגים שונים, בעיקר בגודל המדגם (מספר נבדקים) ותהליכי הבקרה (מחקרים מבוקרי פלסבו, כפולי סמיות).
דווחי מקרה
דווחי מקרה מתארים מקרים בודדים, לעתים ייחודיים וחד-פעמיים, אשר לא תמיד ניתן להסיק מהם לגבי כלל האוכלוסייה. יחד עם זאת, דיווחי מקרה נותנים כיוונים למחקרים עתידיים.
לדוגמא: הצמח שעונית (Passiflora incarnate) נחשב לרוב בטוח לשימוש ונטול תופעות לוואי. סקירת מחקרים קליניים שנערכה בשנת 2013 קבעה כי לשעונית פרופיל בטיחות גבוה(124). עם זאת, קיים דיווח מקרה בודד(125) על אישה שנטלה שעונית על דעת עצמה, בטווח המינונים הרפואי וחוותה תופעות לוואי עיכוליות (בחילה, הקאה) וקרדיו-וסקולריות (Qtc מוארך, טכיקרדיה חדרית חולפת).
דוגמא נוספת: אסטרגלוס נחשב לצמח בטוח לשימוש. לא ידוע על רגישות, תופעות לוואי או מינון יתר(126). יחד עם זאת, קיים דיווח יחיד מסוגו אודות אישה בת 38, שבדמה נמצאו ערכים חריגים של הסמן הסרטני CA19-99 ובסריקות CT נצפו ציסטות קטנות בכליה ובכבד, בעקבות שתיית תה אסטרגלוס מדי יום במשך חודש. הציסטות נעלמו וערכי הסמן הסרטני חזרו לנורמה חודשים ספורים אחרי שהפסיקה לצרוך את הצמח. ראוי לציין כי זהו מקרה נדיר ללא תקדים בספרות הרפואית, על אף שימוש נרחב גם בקרב חולי סרטן. ייתכן כי האישה המתוארת סבלה מרגישות ספציפית לצמח או לאחד ממרכיביו. כמו כן במאמר לא מצוין האם בוצעו בדיקות לזיהוי ודאי של הצמח(127).
מחקרי עוקבה (Prospective trials)
מחקרי עוקבה הם מחקרים תצפיתיים הבוחנים תגובות הדדיות בין צמחים ובין תרופות כפי שהתרחשו באופן טבעי באוכלוסייה ללא התערבות החוקרים. מחקרי עוקבה מלמדים אותנו על קשר מתאמי ולא על קשר סיבתי בין הטיפול ובין ההשפעות הנצפות על הנוטלים, כיוון שיתכן וישנם משתנים אחרים המשפיעים על התוצאות. בהעדר בקרה על משתנים לא ניתן ליחס בוודאות את ההשפעה למשלב הצמח והתרופה. עם זאת, מחקרי עוקבה יכולים לזהות תגובות הדדיות אפשריות ברמת האוכלוסייה ולהוות בסיס למחקרים התערבותיים.
לדוגמא: מחקר עוקבה רטרוספקטיבי(128) שנערך בטאיוואן בחן את השפעות הצריכה של צמחי מרפא סינים בשילוב עם תרופות פסיכיאטריות בקרב חולים סכיזופרנים. שכיחות השימוש בצמחים סינים בקרב 1795 חולים סכיזופרנים נוטלי תרופות היתה 36.4%. שיעור הנבדקים שחוו שיפור במצבם היה גדול יותר במובהק בקרב הנבדקים שנטלו צמחים בהשוואה לאלו שלא נטלו (61.1% לעומת 34.3%). אולם, מספר קטן אך מובהק של נבדקים שנטלו צמחים בשילוב עם תרופות חוו תוצאות שליליות (7.2% לעומת 4.4%). הסיכוי לחוות תוצאות שליליות גבר כשמשך הנטילה של משלב התרופות והצמחים עלה על שלושה חודשים. כ-60% ממקרי התוצאות השליליות נקשרו לנטילה משולבת של הצמחים Radix Bupleuri, Fructus Gardenia, Fructus Schisandrae, Radix Rehmanniae, Akebia Caulis, Semen Plantaginis בשילוב עם התרופות Quetiapine, Clozapine ו-Olanzepine.
מחקרים קליניים פתוחים (Open Label Study)
מחקרים קליניים פתוחים הם מחקרים התערבותיים שבהם כל הנבדקים נוטלים את משלב התרופה והצמח וחשופים למידע על סוג הטיפול הניתן להם. מחקרים פתוחים מאפשרים לייחס את ההשפעות הנצפות לטיפול, אך לא תמיד ניתן לדעת אם ההשפעה היתה משמעותית (לא היתה מתקבלת באותה מידה ללא ההתערבות) או האם התקבלה כתוצאה מהטיות (למשל אפקט פלסבו על הנבדקים המודעים לטיפול שקיבלו).
לדוגמא: במחקר פתוח(129) שארך 8 שבועות, 259 חולים עם הפרעות ראומטיות נטלו 960 מ"ג תמצית ציפורני השטן (Harpagophytum procumbens) ביום (טבליות מטינקטורה מיובשת), לצד תרופות שונות לשיכוך כאב. המטופלים חוו שיפור באיכות החיים והפחתה משמעותית בכאבים בגב ובגפיים. כעבור 8 שבועות, 26% מהמטופלים הפסיקו ליטול תרופות לשיכוך כאב, ו-45% נוספים הפחיתו במינון התרופות.
לעומת זאת, במחקר קליני אקראי וכפול סמיות(130), 122 חולי דלקת מפרקים ניוונית (OA) של הברך או של מפרק הירך נטלו 100 מ"ג Diacerhein ביום לצד 2.6 גרם אבקת ציפורני השטן או פלסבו, במשך 44 חודשים. המטופלים הורשו להשתמש גם בתרופה Diclofenac (ממשפחת ה-NSAID's) ובפראצטמול (Acetaminophen). לא היה הבדל במידת ההפחתה בכאב בין הקבוצה שנטלה ציפורני השטן ובין הקבוצה שנטלה פלסבו, אך בקרב המטופלים שנטלו ציפורני השטן נצפה שיעור נמוך יותר של תופעות לוואי (שלשול בקרב 8% לעומת 27%) ושימוש פחות באופן משמעותי במשככי כאב נוספים.
מחקרים אקראיים מבוקרים (RCT - Randomised Controlled Trials)
מחקרים אקראיים מבוקרים כוללים בקרות של סמיות, אקראיות ופלסבו או טיפול השוואתי.
במחקרים העוסקים בתגובות הדדיות נהוג לשלב בין צמחי מרפא לתרופות אשר ידוע אילו אנזימי כבד או מסלולים מטבוליים אחרים מעורבים בחילוף החומרים שלהן. כך ניתן לבחון את השפּעת צמחי המרפא על מסלולי חילוף החומרים בכבד ובגוף בכלל. הבדיקה נעשית בדרך כלל על ידי בחינת רמות החומרים בדם ובשתן בשלבי התהליך השונים.
מחקרים קליניים אקראיים מבוקרים הנערכים בקרב חולים הנוטלים תרופות וצמחי מרפא מספקים את המידע האיכותי ביותר על תגובות הדדיות, אך הם לא תמיד ניתנים לביצוע מבחינה אתית ומעשית. לפיכך בחלק מהמקרים עלינו להסתפק במחקרים קליניים הנערכים על מתנדבים בריאים.
סקירות שיטתיות ומטא אנליזות
סקירות שיטתיות ומטא אנליזות יכולות לתת מענה מסוים לשונות המתקבלת במחקרים קליניים מבוקרים על ידי סיכום המידע הקליני הקיים, הערכת תוקף הממצאים והסיכון להטיה בכל מחקר, והצעת הסברים לשונות זו(131). עם זאת, גם לסקירות שיטתיות ולמטא אנליזות יש מגבלות. סקירות המסתמכות על מחקרים קליניים מעטים או לא איכותיים (המתבססים על מדגמים קטנים או חסרי בקרה מספקת) עלולות להוביל למסקנות לא מדויקות. כמו כן, חוסר אחידות וסטנדרטיזציה בשימוש בתכשירים צמחיים, וסוגי הכנות שונים של צמחים מקשים על עריכת ההשוואה והסקת המסקנות.
לדוגמא: בסקירה מקיפה(132) הוערכה היעילות והבטיחות של השימוש בתוספי קיפודנית שונים (Echinacea spp) לטיפול בהצטננות ולמניעתה. בסקירה נכללו 24 מחקרים קליניים כפולי-סמיות ובוצעו סה"כ 33 השוואות בין טיפול בקיפודנית לעומת פלסבו. בסקירה זו התקשו החוקרים לבצע ניתוח כולל של הנתונים בשל הטרוגניות גבוהה בין המחקרים השונים בהם נעשה שימוש במיצוי של זני קיפודנית שונים, שהופקו מחלקים שונים של הצמח, בצורות נטילה שונות ועם מינון שונה של הרכיבים הפעילים, זאת בנוסף להבדלים מתודולוגיים בין המחקרים. מסקנת החוקרים היתה כי לא נמצאה עדות ליתרון בשימוש בתוספי קיפודנית לטיפול או למניעה של הצטננות בהשוואה לפלסבו, על אף שלחלק מהתוספים נרשמה תועלת כלשהי.
סיכום פרק מקורות מידע
מחקרי In silico, מחקרי מעבדה ומחקרי בעלי חיים לא תמיד מנבאים תגובות הדדיות בין צמחים ובין תרופות בבני אדם, אך גם בינם ובין עצמם יש מדרג. מחקרי in silico מאפשרים לנסח השערה תיאורטית אך אינם עומדים בפני עצמם כי אינם מתרחשים ב"עולם האמיתי". מחקרי מעבדה תקפים במידה מוגבלת היות שהם מלמדים רק על תגובות הדדיות ברמת התא והרקמה ולא על השפעות הגומלין של מערכות מטבוליות מורכבות בגוף השלם.
מחקרי בעלי חיים מספקים הבנה טובה יותר להשפעות הגומלין המורכבות של המערכות המטבוליות בגוף החי, אך לא תמיד יש דמיון מוחלט בין בעלי החיים ובין בני האדם במבנה ובתפקוד של המערכות, בפתוגנזה של מחלות וכן במינון הצמחים ו/או התרופות הנדרשים כדי להשיג השפעה. בכל מקרה עלינו להעדיף מחקרי בעלי חיים בעלי דמיון מטבולי לבני האדם בהקשר הנחקר, המשתמשים במודל מחקרי הקרוב ככל הניתן למצב החולי האנושי ובמינוני צמחים ותרופות המקבילים למינונים המקובלים בבני האדם.
גם בין מחקרים בבני אדם יש שונות גדולה במהימנות ובתוקף ומכאן שגם ביכולת שלנו לגזור מסקנות לגבי תגובות הדדיות בין צמחים ובין תרופות. מחקרים תצפיתיים כגון דיווחי מקרה ומחקרי עוקבה יכולים להצביע על קשר בין נטילה בו זמנית של צמח ותרופה ובין תסמינים שנצפו ברמת הפרט או האוכלוסייה, אך זהו קשר מתאמי ולא קשר של סיבה ותוצאה. היתרון של מחקר עוקבה על פני דיווח מקרה בודד הוא שהוא שולל אפשרות שהקשר הנצפה הוא חריג וחד פעמי, זאת בהנחה שמחקר העוקבה מתבסס על מדגם מייצג של האוכלוסייה הכללית.
במחקרים קליניים, שליטה במשתנים מאפשרת לנו להניח שהתוצאות הנצפות אכן נובעות מהטיפול במשלב הצמח והתרופה.
יחד עם זאת, על מנת לאמוד את עוצמת ההשפעה ולשלול הטיות אפשריות יש לבצע בקרה וסמיות אשר קיימים במחקרים קליניים מבוקרים כפולי סמיות ומבוקרי פלסבו או טיפול השוואתי. מחקרים קליניים שנערכו בקרב חולים הנוטלים תרופות עדיפים על פני מחקרים שנעשים בנבדקים בריאים, היות שמחקרים אלו משקפים בצורה טובה יותר תגובות הדדיות בין צמחים ובין תרופות כפי שהן מתרחשות בפועל.
סקירות שיטתיות של מחקרים קליניים אוספות עבורנו את המידע הקיים ומעריכות את תוקף הממצאים באופן שמאפשר להסיק מסקנות ישירות על תגובות הדדיות בין צמחים ובין תרופות, אך גם הן מוגבלות במספר ובאיכות של המחקרים הקליניים שעליהן הן נסמכות. יש להעדיף סקירות המתבססות על מספר רב ככל הניתן של מחקרים קליניים איכותיים, השואפים לאחידות בסוגי ההכנות של התכשירים הצמחיים ובמינוניהם.
קיימות סיבות אפשריות נוספות לשונות בתוצאות המחקרים. חלקן נעוצות במבנה המחקר וחלקן באוכלוסייה הנבדקת. להלן פירוט קצר:
הבדלים הקשורים בתכנון ומבנה המחקרים
אופן הנטילה - כפי שכבר צוין, לאופן נטילת הצמחים והתרופות (לדוגמה: נטילה פומית לעומת הזרקה או עירוי) יש השפעה מכרעת על דפוסי ההפעלה של האנזימים המטבוליים השונים במעיים ובכבד. לדוגמא: מיץ ג'ינג'ר (Zingiber officinale) מפחית את הזמינות הביולוגית של התרופה Cyclosporine בנטילה פומית אך לא במתן תוך ורידי(133).
מינון - השפּעת צמחים על חילוף חומרים תרופתי היא לרוב תלוית מינון, אך יש שההשפעה היא דו כיוונית (השפעה מסוימת במינון נמוך והשפעה הפוכה במינון גבוה). לדוגמא: בתנאי מעבדה(134) פרע מחורר (Hypericum perforatum) הדגים הגברה של פעילות האנזימים CYP2C19 ו-CYP2E1 במינון נמוך ועיכוב של פעילות האנזימים הללו במינון גבוה. גינקו דו אונתי אף הוא הדגים הגברה של פעילות האנזים CYP2C19 במינון נמוך ועיכוב של האנזים במינון גבוה, אך בעוצמה פחותה בהשוואה לפרע מחורר(134).
משך ההתערבות - למשך ההתערבות יש משמעות. לעתים נראה השפעה נבנית לאורך זמן של צמחים על חילוף חומרים תרופתי, לעתים נראה התרגלות והפחתה של השפעה, או דו כיווניות של השפעה כתלות במשך ההתערבות (השפעה מסוימת בשימוש קצר והשפעה שונה בשימוש ממושך). כך למשל, מיצוי פרי השכיזנדרה (Schisandra chinensis) מעכב את פעילות אנזים הציטוכרוֹם CYP3A בכבד ובמעי כשהוא ניטל לטווח קצר, אך מזרז את פעילות האנזים כשהוא ניטל לטווח ארוך(135).
הבדלים בהשפּעת רכיבים בודדים לעומת הצמח השלם - בניגוד לתרופות, המורכבות בדרך כלל ממולקולה בודדת, צמחי מרפא מכילים רכיבים פעילים רבים. לכן, מחקרים אשר בודקים השפּעת רכיבים צמחיים מבודדים על מנגנוני חילוף חומרים תרופתי אינם מייצגים נכונה את ההשפעה של הצמח השלם על אותם מנגנונים וקשה להסיק מהם מסקנות רלוונטיות לפרקטיקה הקלינית.
לדוגמא, בתנאי מעבדה(73), תמצית מתנולית של רוזמרין (Rosmarinus officinalis) העלתה את ריכוז התרופות Doxorubicin ו-Vinblastine בתאי סרטן שד אנושיים, על ידי מניעת היצמדותן למשאבות P-gp. יש לציין כי הרכיבים המבודדים carnosic acid, carnosol ו-rosmarinic acid לא הדגימו פעילות זו. לעתים, רכיבים שונים בצמח מבטלים השפעות מבודדות של רכיבים אחרים. לדוגמא, חומצה אצטיל-סאליצילית (אספירין) היא חומר פעיל נוֹגד דַלקת המצוי במספר צמחי מרפא כגון ערבה לבנה (Salix alba) או עוקצנית (Filipendula ulmaria). החומצה, כאשר ניתנת מבודדת, כתרופה, עלולה לגרום לאורך זמן לכיבים ודימומים במערכת העיכול. לעומת זאת, שימוש בצמחי המרפא אשר הוזכרו לעיל אינו גורם לתופעת לוואי שלילית זו וצמח המרפא עוקצנית אף מותווה לטיפול בכיבים פפטיים. למרות האמור, למחקרים הנעשים על רכיבים מבודדים יתרון בכך שהם מסייעים לנו להבין אלו מרכיבי הצמח אחראים לאיזו פעילות, אולם על מנת להעריך תגובות הדדיות אפשריות נעדיף מחקרים בהם נעשה שימוש בצמח השלם.
בחירת סובסטרטים - הבדלים בתוצאות המחקרים עשויים לנבוע מהבחירה הספציפית בתרופות המשמשות סובסטרט לאנזים מסוים. לדוגמא, צמחים מסוימים כמו גינקו(136) או רכיבים צמחיים כמו ג'ינסנוסיידים(137) משפיעים על האנזים CYP3A4 אולם השפעה זו משתנה כתלות בסובסטרט. שילוב תמצית הצמח גינקו עם הסובסטרט BFC (הידוע בשמו: 7-benzyloxy-4-trifluoromethylcoumarin) הוביל לעיכוב של 3% בעוד ששילוב גינקו עם הסובסטרט BzRes (הידוע בשמו: resorufin benzyl ether) הביא לעיכוב של 43%(136). לגבי הג'ינסנוסיידים, כשאלו שולבו עם התרופה Carbamazepine נצפתה הפעלה משמעותית של האנזים, וכאשר שולבו עם התרופה Nifedipine נצפה דווקא עיכוב של האנזים(137).
הבדלים בשמות ובסיווגים של צמחים – שמות הצמחים ברפואה הסינית למשל לא תמיד חופפים לסיווג הצמחים המקובל במערב. כך למשל, לעתים שם סיני מסוים מתייחס לכמה מינים של צמחים שלכל אחד מהם השפעה שונה על חילוף החומרים של תרופות. לדוגמא: ברפואה הסינית Rhei radix et rhizoma מתייחס למינים Rheum palmatum, Rheum tanguticum ו-Rheum officinalis, ולחילופין, שמות סיניים שונים מתייחסים לעתים לחלקים שונים של אותו צמח. לדוגמא: השמות Da Qing Ye ו- Ban Lan Gen מתייחסים לעלי הצמח ושורש הצמח Isatis tinctoria בהתאמה. אי הכרת ההבדלים עשוי להיות סיבה לאי הבנת ההשפעות השונות על חילוף החומרים של תרופות. לעתים יתכנו אף טעויות בזיהוי הצמח(138).
הבדלים בתנאי גידול ועיבוד - ריכוז החומרים הפעילים בצמח משתנה כתלות במקור הצמח, באופן גידולו (מקום הגידול, זמן הקטיף, תנאי האחסון) ובאופן עיבודו(139).
הבדלים בסוגי הכנות/מיצויים - ריכוז החומרים הפעילים משתנה גם כתלות בסוג ההכנה של הצמח. קיימים הבדלים בין מיצוי מימי לעומת מיצוי אתנולי או תמצית יבשה לעומת תמצית נוזלית. לדוגמא, מיצוי של מרווה סינית (Salvia miltiorrhiza) באתיל אצטט הדגים בעכברים השפעה מעכבת על אנזימי הציטוכרוֹם CYP1A, CYP2C ו-CYP3A. עם זאת, לא הודגמה השפעה מעכבת של אנזימי הציטוכרוֹם למיצוי המימי של הצמח(140).
בנוסף לכל האמור לעיל, יש לזכור שמרבית המחקרים העוסקים בתגובות הדדיות בין צמחים ותרופות מתייחסים להשפעות של צמחים בודדים ולא של פורמולות, בעוד שבפרקטיקה הקלינית נהוג לשלב צמחי מרפא שונים על מנת להעצים את ההשפעה הטיפולית ולהפחית תופעות לוואי אפשריות. יש להניח שלעצם שילוב הצמחים בפורמולה יש השפעה גם על פרמקוקינטיקה וגם על פרמקודינמיקה.
הבדלים הקשורים בשונות בין הנבדקים
לעתים אצל נבדקים שונים אנו נתקלים בשונות גנטית המובילה לפעילות שונה של אנזימים המעורבים בחילוף החומרים התרופתי. כתוצאה מכך גם מידת התגובה ההדדית בין תרופות ובין צמחים שונה מאדם לאדם.
סיבה אחת להבדלים אלה היא שונות גנטית מולדת. לדוגמא, במחקר קליני(141) שנערך בקרב שמונה עשרה נבדקים בריאים נמצא שהשפּעת גינקו דו אונתי (Ginkgo biloba) על פירוק התרופה Omeprazole היא תלוית גנוטיפ ספציפי של אנזים הציטוכרוֹם CYP2C19.
סיבה שניה היא שונות גנטית נרכשת (אפיגנטיקה). אורח החיים גורם להבדלים בחילוף החומרים התרופתי הקשורים בגיל, במין ובמצבי בריאות וחולי, וכן בהרגלי החיים הכוללים תזונה, פעילות גופנית, מידת הדחק, איכות השינה, סך כל התרופות הניטלות על ידי האדם ועוד(142). כל אלו משפיעים על ביטוי של גנים שונים, ביניהם גם גנים הקשורים לחילוף חומרים תרופתי.
גם הרכב הפלורה החיידקית במעיים משפיע על חילוף חומרים. חיידקי המעי מסייעים לפירוק רכיבים שונים העוברים במעי ובכלל זה גם רכיבים צמחיים. לדוגמא: הרכיב הפעיל baicalin מהצמח קערורית סינית (Scutellaria baicalensis) מפורק על ידי חיידקי המעי ל-baicalein שממשיך ומתפרק לתת רכיבים פעילים הנספגים למחזור הדם(143). הרכב חיידקי המעי שונה מאדם לאדם בהתאם לתזונתו, בריאותו, רמת הדחק בחייו, ומכאן שעשויים להיות הבדלים בהשפעות הרפואיות והפרמקולוגיות בין נבדקים שונים הנוטלים מינון זהה של רכיבים צמחיים.
5. סיכום, מסקנות ויישום קליני
הבנה עמוקה של ההשפעות השונות של צמחי המרפא על המערכות המטבוליות של הגוף, לצד ניתוח ביקורתי של העדויות והממצאים השונים, מובילים לשימוש מושכל ובטוח בצמחי מרפא לצד תרופות, שילוב המיועד להשגת השפעה רפואית מיטבית.
עם זאת, חשוב לזכור שבראש ובראשונה אל לנו להזיק, ואם ידועות תגובות הדדיות מסוכנות בין צמחים ותרופות, או אם אין מספיק מידע לגבי בטיחות השימוש בצמח כלשהו עם תרופה כלשהי, מוטב לנקוט זהירות בשילוב או אף להימנע ממנו.
יש להפעיל שיקול דעת לגבי כל מקרה ומקרה בנפרד ולבחון את התועלת האפשרית של השילוב ואת הסיכון הטמון בו.
מידת התועלת תלויה בהשפעה הרפואית הרצויה, נחיצותה למטופל ולטיפול הרפואי, ואיכות המידע הקיים לגבי יעילות הטיפול.
מידת הסיכון תלויה בשני גורמים. האחד, מסוכנות התגובה ההדדית האפשרית והשני איכות המידע הקיים.
להלן טבלת "אצבע" ליישום קליני, ולאחריה מספר דוגמאות:
| |
תועלת גבוהה |
תועלת נמוכה |
| סיכון גבוה |
זהירות |
להימנע |
| סיכון נמוך |
לשלב |
לשקול |
תועלת גבוהה וסיכון גבוה - שילוב פטריית קורדיספס (Cordyceps sinensis) עם תרופות מדכאות חיסון במושתלי כליה למטרת תמיכה ואיזון מערכת החיסון של מטופלים הסובלים מזיהומים חוזרים. למרות הסיכון התיאורטי כי הטיפול הצמחי עלול לפגוע ביעילות הטיפול התרופתי ולגרום לדחיית השתל, סקירה שבחנה מספר מחקרים קליניים(144) מצאה כי השילוב היה בעל פרופיל בטיחותי גבוה וכי השילוב מביא לתפקוד טוב יותר של האיבר המושתל, שיעור נמוך יותר של דחיית שתל אקוטית, שיפור במדדי אנמיה, לויקופניה, תפקודי כבד והיארעות זיהומים. במקרה זה השילוב נראה ראוי אך יש לעשותו בזהירות, בשיתוף מידע עם כל גורמי הטיפול ובמעקב וניטור של המדדים הרלוונטיים.
תועלת גבוהה וסיכון נמוך - שילוב כורכום (Curcuma longa) עם נוגדי דלקת. כמפורט כאן, מספר מחקרים קליניים הדגימו הגברת השפעה אנטי דלקתית, תוצאות קליניות משופרות והפחתה בתופעות לוואי תרופתיות(82-85). במקרה זה, התועלת ללא ספק גבוהה ולא ידוע על סיכונים ולכן כדאי לשלב.
תועלת נמוכה וסיכון גבוה – שילוב ג'ינסנג קוריאני (Panax ginseng) או סיבירי (Eleutherococcus senticosus) עם התרופה דיגוקסין (הסדרת קצב לב) למטרת תמיכה במערכת הקרדיו-וסקולרית. למרות הפעילות המאתנת הכללית של הצמחים המוזכרים, כלל לא ברורה מידת יעילותם בטיפול בהפרעות קצב לב. מצד שני, שילוב שני הצמחים עם התרופה עלול לשבש את התוצאות המתקבלות בבדיקת רמת התרופה בדם ללא שינוי אמיתי ברמת התרופה בדם(145-146). בנוסף, לתרופה זו טווח תרפויטי צר וכל שינוי ברמת התרופה בדם עלול להוביל לכשל בטיפול או לרעילות. במקרה זה קיים סיכון גבוה (שינוי המינון ללא צורך) בשילוב עם תועלת מוטלת בספק ולכן יש להימנע משילוב זה.
תועלת נמוכה וסיכון נמוך - שילוב ויתניה משכרת (Withania somnifera) יחד עם תירוקסין (תרופה לאיזון בלוטת התריס) למטרת תמיכה בבלוטה. לתרופה בפני עצמה השפעה מוכחת על בלוטת התריס, מה גם שלא קיימות ראיות קליניות כי השילוב מביא לתוצאות עדיפות. מצד שני, לצמח השפעה מאתנת אשר עשויה לשפר את ההרגשה הכללית ואיכות החיים של המטופל. לא ידוע על סיכון בשילוב ולכן "אין מה להפסיד".
כללים לשילוב בטוח של צמחי מרפא עם תרופות בפרקטיקה הקלינית:
- ביצוע רישום מדויק של כל התרופות הניטלות על ידי המטופל, מינון כל תרופה וזמן לקיחתה.
- בדיקה לגבי כל תרופה באשר לטווח התרפויטי שלה ולתופעות לוואי אפשריות.
- בדיקה במאגרי מידע עדכניים אם קיימות תגובות הדדיות בין התרופות לבין צמחי המרפא אותם ברצוננו לרשום.
- ניתוח כל תגובה הדדית בהתאם לתועלת האפשרית ולסיכון שבשילוב.
- שיתוף המטופל במטרות ותכנית הטיפול ובכללי בטיחות אם נדרשים כאלו.
- יידוע הרופא המטפל בנוגע לטיפול הצמחי בשיחה או במכתב, וחתירה במידת האפשר לשיתוף פעולה עמו בתכנון המשך הטיפול. רצוי לכלול בתקשורת עם הרופא המטפל הפניה למחקרים רלוונטיים.
- במקרה הצורך, יש לנקוט זהירות בשימוש, להעלות את מינון צמחי המרפא בהדרגה ו/או לערוך מעקב וניטור של המדדים הרלוונטיים.
מידע מפורט ועדכני לגבי תגובות הדדיות של צמחי מרפא עם תרופות מופיע במונוגרף של כל צמח באתר. בנוסף, ערכנו עבורכם מדריך שימושי חינמי המאפשר מציאת תגובות הדדיות על פי משפחות של תרופות.
6. פרק בונוס - סובייקטיביות בפירוש הנתונים
כללי | הערכת יתר | הערכת חסר
כללי
המגבלות הקיימות במחקר הקיים, הן בהיקפו והן באיכותו, כפי שפורטו במאמר, מביאות למצב בו קיים מידע חלקי בלבד אשר הרלוונטיות הקלינית שלו אינה ברורה.
כיוון שכך, נותר מקום לפרשנות באשר לנתונים וליישומם בפועל.
לדעת הכותבים קיים פער, משמעותי לעתים, בין הנתונים הקיימים לבין הפרשנות הניתנת להם ויישומם בפרקטיקה הרפואית, פער אשר הינו לרוב "לרעת" צמחי המרפא.
מאחר ומדובר כאמור בפרשנות, תחילה גילוי נאות:
כותבי מאמר זה הינם הרבליסטים קליניים אשר השקפתם על שילוב צמחי מרפא בטיפול רפואי ברורה. בנוסף, העיסוק ברפואת צמחים משמש לכותבים הן כמקור השראה והן כמקור פרנסה כך שגם להם יש הטיה (חיובית) בנושא.
מקורות מידע רבים, בעיקר הממסדיים, נוטים לאמץ גישה שמרנית ולהכריז על תגובה הדדית וסכנה בעקבות כל מחקר המציע תגובה הדדית שלילית, גם אם בוצע בתרביות תאים בלבד ואינו בעל משמעות קלינית ברורה, בעוד שמידע בעל איכות מתודולוגית דומה המציע פעילות רפואית חיובית או מצביע על תגובות הדדיות חיוביות נותר בצל.
בנוסף, קיימים מקרים לא מעטים בהם כותבים חוקרים מסקנות "מחמירות" אשר מעוותות את המידע הקיים. במקרים אחרים, למרות מחקרים קליניים המוכיחים יעילות ובטיחות שילוב צמחי מרפא עם תרופות בפרוטוקול טיפולי מסוים, המידע אינו מיושם בפרקטיקה הרפואית המקובלת.
למרות שייתכן כי מדובר באי הבנות נקודתיות, במרבית המקרים, אם לא כולם, הפערים הם לרעת הצמחים, כלומר נגד שילוב צמחי מרפא כטיפול בודד או בשילוב עם תרופות. המגמה השלילית הזו בהצגת הנתונים מעלה תהיות באשר להטיה אפשרית בתפיסה הכללית, הממסדית ובעקבותיה הציבורית, לגבי השימוש והשילוב של צמחי המרפא בפרקטיקה הרפואית.
הטיה זו באה לידי ביטוי גם בהערכת יתר של תגובות הדדיות שליליות וגם בהערכת חסר של תגובות הדדיות חיוביות, כפי שנציג להלן:
הערכת יתר
נראה כי בספרות הרפואית ובגישה הממסדית השמרנית, נושא התגובות ההדדיות האפשריות זוכה להערכת יתר מוגזמת. כך למשל, חיפוש מהיר של תגובות הדדיות בין צמחי מרפא לבין תרופות כימותרפיות במאגר פאבמד מוצא למעלה מ-750 מאמרים בנושא. מקורות ומאגרי מידע רבים (ובכללם אתר נטורופדיה) מפרסמים מידע על תגובות הדדיות שליליות אפשריות, מידע אשר מרביתו מגיע ממחקרים אשר בוצעו על תרביות תאים.
אך האם תגובות הדדיות שליליות אלו אכן מתגשמות במציאות?
במחקר תצפיתי(172) שפורסם בשנת 2017 נחקר הפוטנציאל לתגובות הדדיות בין תרופות ובין תרופות וצמחי מרפא בקרב חולי סרטן. במסגרת המחקר אספו החוקרים נתונים אודות כל התרופות וצמחי המרפא שנלקחו על ידי כל מטופל. באמצעות חיפוש נרחב במאגרי הנתונים זוהו התגובות ההדדיות התיאורטיות הקיימות, וההשפעה הקלינית האפשרית שלהם הוערכה על ידי רוקח קליני והועברה לאונקולוג המטפל. נמצא כי מבין 149 מטופלים שנכללו במחקר, 26 מטופלים (17.4%) היו בסיכון לתגובות הדדיות בין תרופות, שעשויות להיות בעלות משמעות קלינית, כאשר 4 מטופלים (2.7%) סבלו בפועל מתגובות הדדיות בין תרופות. נטילה של שתי תרופות או יותר במקביל נמצאה קשורה בסיכון גבוה פי 2.5 לתגובות הדדיות בעלות משמעות קלינית (p=0.03). כמו כן, מבין 149 המשתתפים במחקר, 84 מטופלים (56.4%) דיווחו על שימוש בצמחי מרפא במקביל לטיפול האנטי-סרטני, כאשר בקרב 75 מטופלים (50.3%) החוקרים זיהו 122 תגובות הדדיות אפשריות בין תרופות לבין צמחי מרפא. יחד עם זאת, באף מקרה לא דווח על ידי האונקולוג המטפל על תגובות הדדיות קליניות מהם סבלו המטופלים בפועל.
סקירה שיטתית(147) שהתפרסמה בשנת 2014 בדקה מאגרי מידע ומחקרים בהם נבדק השימוש בתוספי תזונה ובצמחי מרפא במקביל לטיפול תרופתי בקרב חולי סרטן. מתוך 806 חולים שנכללו בסקירה, 433 שילבו תוספים וצמחים עם תרופות. בקרב חולים אלו, זוהו 167 תגובות הדדיות שליליות אפשריות אצל 60 חולים. כאמור, מרבית התגובות שזוהו היו תאורטיות או מבוססות מחקרי מעבדה, ללא תימוכין קליני קודם.
התוצאה: באף אחד מן המחקרים שנסקרו לא דווח על תופעת לוואי משמעותית של השילובים. אף לא אחד.
מסקנת החוקרים היתה כמובן שקיימת הערכת יתר של תגובות הדדיות שליליות אפשריות ושיש להוסיף לחקור את הנושא בהתבסס על ראיות מבוססות לתגובות הדדיות אפשריות, לא רק בכדי להימנע מתגובות שליליות אלא גם כדי לספק תמיכה לבטיחות השילוב כאשר יש בו צורך.
אז כיצד קורה שקיימות כל כך הרבה תגובות הדדיות אפשריות אשר אינן מתקיימות במציאות הקלינית?
חלק מהתשובה לשאלה זו נמצא בנקיטת זהירות יתרה כיוון שאין מידע מספק וחד משמעי.
לחלוטין הגיוני ומקובל. הרי מוטב להיזהר כאשר יש אפשרות לגרום נזק.
חלק אחר טמון בעובדה שמרבית האזהרות לגבי תגובות הדדיות מבוססות על מחקרי מעבדה ומחקרים בבעלי חיים ולא על מחקרים קליניים. כאמור, מחקרים אלו (מעבדה ובעלי חיים) אינם יכולים לנבא את ההשפעות הקליניות הממשיות.
אבל החלק המטריד הוא זה שטמון בפערים בין המידע הגולמי העולה מהמחקרים לבין המידע המתפרסם בעקבותיו בספרות המקצועית. לעתים הפערים משמעותיים עד כדי הפיכת משמעות הממצאים.
הנה שתי דוגמאות:
קוהוש שחור וטמוקסיפן - גורמים מקצועיים כגון אונקולוגים, רופאים ומטפלים חוששים לתת קוהוש שחור (Cimicifuga racemosa) לחולים בסרטנים תלויי הורמונים מחשש להמרצת הגידול ו/או לפגיעה ביעילות התרופות. כך למשל באינדקס צמחי המרפא של בית החולים סלואן קייטרינג, הנחשב למקור מהימן, מופיעה אזהרה על פיה קוהוש שחור עשוי להפריע לפעילות התרופה טמוקסיפן על סמך מחקר מעבדה שפורסם בנושא(148). זהו המקור היחיד המופיע בהקשר לאזהרה, אולם בסקירה עדכנית ומקיפה שערכנו מצאנו שני מחקרים קליניים מבוקרים(99,149), מחקר עוקבה פרוספקטיבי אחד(150), שני מחקרים שנערכו בקרב מכרסמים(151-152) וארבעה מחקרי מעבדה(153-156) שעסקו בפעילות מעכבת הגידולים של קוהוש שחור וביעילות השילוב של קוהוש שחור עם טמוקסיפן ותרופות כימותרפיות נוספות. בכל המחקרים, למעט המחקר שהוזכר לעיל, שציין שקוהוש שחור עלול לעכב את שפעול התרופה טמוקסיפן, נמצא כי לא רק שהקוהוש אינו מפריע לפעילות התרופות אלא אף מגביר את יעילותן ומונע תופעות לוואי בלתי רצויות.
גינקו דו אונתי וכימותרפיה מסוג Paclitaxel - במאמר סקירה(157) העוסק בסכנות פוטנציאליות של שילוב צמחי מרפא בטיפול קונבנציונלי בסרטן, פורסם כי גינקו דו אונתי (Ginkgo biloba) עשוי לעכב את חילוף החומרים של התרופה הכימותרפית Paclitaxel. מידע זה אינו מדויק ואינו מייצג את הממצאים המחקריים המקוריים. בחינה של המחקר המקורי(158) שעליו מתבססת קביעה זו מעלה כי במחקר נבדקו בתנאי מעבדה שני מיצויים שונים של גינקו והשפּעתם על חילוף חומרים של Paclitaxel בתאי כבד אנושיים: המיצוי הראשון שנבדק היה הידרוליזט של מיצוי גינקו (מיצוי הצמח שעבר פירוק בהידרוליזה על מנת להגביר את ריכוז הפלבונואידים בתמצית). צורה זו של מיצוי, אשר אינה נמצאת כלל בשימוש קליני, היא שגרמה לעיכוב המדובר. המיצוי השני שנבדק הוא המיצוי המקובל של הצמח, בו משתמשים בפועל ברפואת הצמחים. למיצוי זה כלל לא היתה השפעה על חילוף החומרים של התרופה.
הערכת חסר
קיימים לא מעט מחקרים קליניים ומהימנים אשר הדגימו יעילות ובטיחות של שילוב צמחי מרפא לצד הטיפול התרופתי הקונבנציונלי, באופן התומך בפעולתו ומאפשר צמצום של השפעותיו המזיקות.
כזה למשל הוא המקרה של כורכומין. מספר מחקרים קליניים מצאו כי נטילה משולבת עם תרופות נוגדות דלקת (מסוג NSAID's, 5-ASA וסטרואידים) מביאה לשיפור בחומרת התסמינים, בהפחתת שיעור ההתקפים ובהפחתת תופעות הלוואי התרופתיות בקרב חולי קרוהן, קוליטיס ודלקת חלחולת כיבית(82-84), וכן בקרב חולי דלקת מפרקים שגרונית(85) ודלקת מפרקים ניוונית(170-171).
דוגמא נוספת היא שילוב של סטטינים עם מיצוי רימון - מחקר קליני כפול סמיות מבוקר פלסבו(159) מצא כי שילוב של כמוסות מיצוי רימון (Punica granatum) עם התרופה Simvastatin היה יעיל יותר במובהק בהפחתת יצור הכולסטרול ובהפחתת העקה החמצונית לעומת הטיפול התרופתי לבדו. ממצאים אלו נתמכים על ידי מחקרים קליניים נוספים(160-163), מחקרי בעלי חיים(162,164) ומחקרי מעבדה(165) המעידים על תכונותיו של הרימון כמוריד רמות כולסטרול וטריגליצרידים, מפחית חמצון שומנים ומונע התפתחות טרשת עורקים.
ודוגמא אחרונה כוללת שילוב מיני ג'ינסנג עם תרופות נגד סוכרת – בסקירה שיטתית(166) ובמספר מחקרים קליניים(167-169) שבחנו את יעילות הטיפול בסוכרת סוג 2 באמצעות מיני ג'ינסנג (Panax ginseng, Panax quinquefolium) נמצא כי הצמחים הניטלים במינון של 3-5 גרם ליום יעילים בהורדת רמות הגלוקוז והאינסולין בצום ולאחר ארוחה ובשיפור מדדי תנגודת לאינסולין (HOMA-IR, HbA1c) באופן בטוח ונטול תופעות לוואי. על אף חששות תיאורטיים לפיהם השילוב עלול להוביל לירידה גדולה מידי ברמות הסוכר ולגרום להיפוגליקמיה, במחקרים קליניים לא נמצאו ראיות לתגובות הדדיות מסוג זה, ולא נצפו תופעות לוואי ובכללן היפוגליקמיה.
לדאבוננו מידע זה אינו בא לידי ביטוי בפרקטיקה הרפואית. מרבית הרופאים אינם מכירים את המחקרים הללו ובודאי אינם ממליצים על השילובים המוזכרים.
מדוע זה קורה?
לדעתנו בעיקר בגלל חינוך. ההכשרה הרפואית הקיימת כיום מבוססת על הטיפול התרופתי וכמות שעות הלימוד על צמחי המרפא או על שילוב צמחי מרפא עם תרופות שואפת לאפס. גם תוכניות העשרה ועדכון בנושא כמעט שאינן קיימות.
חוסר האסדרה (רגולציה) בנושא המותיר את התחום פרוץ הוא סיבה נוספת. רגולציה של העיסוק בתחום תביא בהכרח לקריטריונים של לימודים ושל עדכון הידע באופן שוטף.
מי יודע, אולי אף נזכה ליום בו שילובים אשר הוכחו כמועילים ובטוחים יוכנסו לסל הבריאות ונוכל כולנו להנות מהם ללא עלות.
ומה עד אז?
עד אז אפשר להמשיך להפיץ את הידע, לשתף את המטופלים ואת רופאיהם במחקרים ובממצאים הקיימים ובעיקר לעשות כמיטב יכולתנו לעזור לאלו אשר רוצים בעזרתנו.
7. נספח 1 - מושגי יסוד
פרמקוקינטיקה – השפּעת הגוף על תרופה, או במלים אחרות חילוף החומרים של התרופה: ספיגתה, פירוקה במעי ובכבד, פיזורה ברקמות והפרשתה מן הגוף.
פרמקודינמיקה – השפּעת התרופה על הגוף, הפעילות הרפואית של התרופה.
אנזימי הפאזה הראשונה בכבד - תפקידם לפרק את התרופות למרכיביהם. החשובים שבהם הם אנזימי ציטוכרוֹם CYP450.
אנזימי הפאזה השניה בכבד - תפקידם לנטרל את תוצרי הביניים הרעילים של התרופות שפורקו על ידי אנזימי הציטוכרוֹם בפאזה הראשונה ולהכינם להפרשה מן הגוף דרך המרה והשתן. בין האנזימים הללו נכללים (glutathione S-tranferase (GST), N-acetyl tranferase (NAT), sulfotranferase (ST) ו-uridine diphosphoglucuronosyl (UGT.
אנזימי ציטוכרוֹם CYP450 – קבוצת אנזימים הממוקמת בעיקר בכבד אך גם במעי ובאיברים נוספים. אנזימים אלה אחראים לחילוף חומרים של מגוון רחב של תרופות. הם שייכים לאנזימי הפאזה הראשונה. האנזימים העיקריים המשתתפים בחילוף חומרים תרופתי של תרופות הם:
CYP3A4, CYP3A5, CYP1A2, CYP2A6, CYP2C19, CYP2C9, CYP3D6 ו-CYP2E1.
UGT – משפחת אנזימים שאחראית לתהליך הגלוקורוניזציה (הוספת חומצה גלוקורונית) למולקולות של חומרים פעילים כדי להעלות את מסיסותם ולהקל את הפרשתם מן הגוף דרך הכליות. הם שייכים לאנזימי הפאזה השניה.
GST - משפחת אנזימים שאחראית להוספת גלותטיון למולקולות של חומרים פעילים בתהליך של קוניוגציה (חיבור לשומנים) כדי לנטרל את רעילותם.
Solute carrier 22 - משפחה של נשאים הכוללת נשאי קטיונים (OCT) ואניונים (OAT) המעבירים יונים דרך קרומי התאים. מצויים בעיקר בכבד ובכליות כחלק ממנגנון ההפרשה האקטיבית של יונים.
ביטוי גנטי של אנזים - בכל התאים מצוי חומר תורשתי זהה, ואולם לא כל הגנים מתבטאים בתאים במידה שווה. גורמים שונים בתא ובסביבתו (כגון רכיבים פעילים של תרופות וצמחים אך גם הורמונים וציטוקינים) עשויים להשפיע על הביטוי הגנטי ועל רמת הפעילות של אנזימים דרך השפעה על גורמי שעתוק גנים.
גורמי שעתוק - קיימים מספר גורמי שעתוק אשר תפקידם לווסת ולבקר את תהליך שעתוק של גנים (שעתוק ה-DNA ל-mRNA) בתהליך יצירת חלבונים. יש גורמי שעתוק שמפעילים את תהליך השעתוק ויש שמפסיקים אותו, והם למעשה הקובעים אילו חלבונים ייווצרו, מתי ובאיזו כמות.
תת קבוצה של גורמי שעתוק (PXR, CAR, Ahr) מגיבה לנוכחות חומרים שונים בתא, שחלקם עלול לגרום לו נזק, על ידי העלאת הביטוי הגנטי של אנזימים המעורבים בנטרול החומרים ופינויים מהגוף.
הגברת פעילות של מערכת האנזימים (Induction) - מתבצעת על ידי העלאת הביטוי הגנטי של האנזימים (הגברת שעתוק mRNA) הגורמת לעלייה בפעילות האנזימים בכבד וכתוצאה מכך עשויה לזרז את פינוי התרופות העוברות דרכם, להוריד את החשיפה הסיסטמית לתרופות ולהפחית את יעילותן.
עיכוב פעילות של מערכת האנזימים (Inhibition) - עיכוב פעילות מתרחש בכמה מנגנונים:
1. עיכוב תחרותי - רכיבים פעילים צמחיים עשויים להתחרות עם תרופות על אתרי קשירה של אנזימים ולחסום קישורים של תרופות לאותם האנזימים.
2. עיכוב לא תחרותי - רכיבים פעילים צמחיים עשויים להיקשר לאנזים ולשנות את יכולתו לפרק את התרופה. השפעות אלה הן תלויות מינון בדרך כלל והפיכות.
3. עיכוב מכאני/לא תחרותי - קישור קוולנטי/מכאני בין רכיבים פעילים צמחיים ובין האנזים, באופן שמנטרל את האנזים לחלוטין ומפחית את מספר האנזימים הזמינים לפירוק התרופה. במקרה זה העיכוב אינו הפיך ואינו תלוי מינון, וחידוש פעילות האנזים תלויה בייצור אנזימים חדשים.
עיכוב בפעילות האנזימים עלול לגרום לעליה בחשיפה הסיסטמית לתרופות, לגרום מצד אחד לעלייה ביעילותן אך מצד שני גם לעלייה בתופעות הלוואי אפשריות וברעילות.
גליקופרוטאין P או בקיצור P-gp - הוא חלבון הנמצא בממברנות התאים ומשמש כמשאבה המוציאה חומרים פעילים מתוך התא אל החלל הבין תאי כדי לווסת כניסה ויציאה של חומרים (ביניהם תרופות) ולהגן על התא מפני רעילות. משאבת P-gp שייכת למשפחה של נשאים אקטיביים קושרי ATP המכונים ABC transporters.
ABC transporters - משפחה של נשאים קושרי ATP הפועלים כמשאבה אקטיבית שתפקידה להוציא חומרים החוצה מהתא. בין הנשאים המשתייכים למשפחה זו ניתן למצוא את גליקופרוטאין P (P-gp) ושני נשאים נוספים שזוהו כגורמי עמידות לתרופות בתאים סרטניים MRP (Multidrug resistance protein) ו- (Breast cancer drug resistance protein) הידוע בשמו: BCRP .
נשאי ABC ובתוכם P-gp פועלים גם בשכבה הפנימית של תאי האנדותל בנימי הדם במוח ויוצרים את מחסום דם המוח (BBB) המגביל כניסת חומרים למערכת העצבים המרכזית.
זמינות ביולוגית (bioavailability) – מונח המבטא את היחס (באחוזים) בין הכמות של החומר (תרופה או צמח) שניטלת לבין הכמות החודרת אל זרם הדם ומגיעה אל אתרי הפעולה הרצויים בגוף.
כך למשל לעירוי או הזרקה זמינות ביולוגית של 100%. לעומת זאת, קיימת שונות גבוהה של זמינות ביולוגית של חומרים הניטלים באופן פומי, והיא יכולה לנוע בין אחוזים בודדים לבין כמעט 100%. הזמינות הביולוגית של תרופה תקבע למעשה את מינון המנה המומלצת ללקיחה על מנת שתהיה יעילה.
חלון תרפויטי של תרופה - טווח המינונים שבהם התרופה פועלת באופן הרצוי וללא סכנת הרעלה. קיימות תרופות (למשל Digoxin, Warfarin, Cyclosporine, Theophylline) להן חלון תרפויטי צר שמשמעותו כי כל ירידה או עלייה ברמת התרופה בדם עלולה לבטל את פעילותה עקב תת מינון או לגרום לרעילות עקב מינון יתר.
חשיפה סיסטמית של תרופה – ריכוז התרופה הניטלת בזרם הדם כפונקציה של הזמן. תלויה בזמינות הביולוגית של התרופה, במינונה ובקצב פינויה מהדם. נמדדת לרוב במונחים של AUC - השטח מתחת לעקומה הפרמקוקינטית.
AUC - השטח מתחת לעקומה הפרמקוקינטית (Area under the curve) מתייחס לריכוז התרופה בסרום ביחס לזמן.
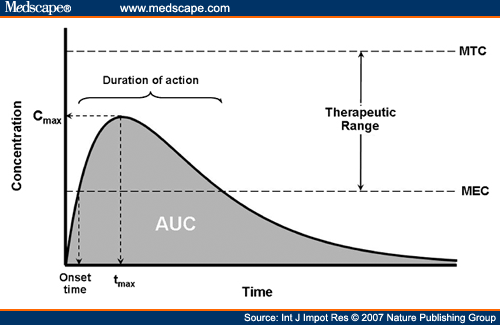
Cmax – מונח בפרמקוקינטיקה המתייחס לריכוז המקסימלי של תרופה בסרום.
t1/2 – זמן מחצית החיים של תרופה - פרק הזמן שנדרש על מנת להוריד את ריכוז התרופה למחצית מריכוזה ההתחלתי.
מחקרי In silico – מחקרים תאורטיים מבוססי הדמיות מחשב וחישובים מתמטיים.
מחקרי In-vitro - מחקרי מעבדה הנערכים על תאים או רקמות מבודדים.
מחקרי In-vivo – מחקרים המתבצעים על אורגניזם חי.
סובסטרט של אנזים - כינוי למולקולה הנקשרת לאתר הקשירה של האנזים ועליה פועל האנזים המשמש כזרז לתגובה כימית כלשהי. לרוב מדובר במולקולות בעלות קשירה ספציפית לאנזימים מסוימים. לעתים האנזים מפרק את הסובסטרט למרכיביו, לעתים שני סובסטרטים נקשרים לאנזים יחדיו ליצירת מולקולה אחת גדולה או כדי להחליף ביניהם תת-רכיבים. סובסטרט בהקשרנו הוא לרוב תרופה הידועה בקשירה ספציפית לאנזים מסוים, ומשמשת כאבן בוחן להשפּעת חומר נוסף (צמח למשל) על פעילות האנזים. אם למשל ידוע שתרופה כלשהי מתפרקת על ידי אנזים, ניתן לבחון כיצד נטילה של צמח בו זמנית משפיעה על קצב פירוקה על ידי מדידת תוצרי הפירוק של התרופה בדם בנקודות זמן שונות.
שונות גנטית (בקרב בני אדם) - הבדלים בין בני אדם נובעים בדרך כלל משינויים בחומר התורשתי בעת העתקתו ושכפולו (שחלוף גנים, מוטציות, פולי-מורפיזם).
שונות נוספת נגרמת עקב הבדלים שמקורם בגיל, במין ובהשפעות סביבתיות (אפיגנטיקה): הרגלי חיים סוג המזון הנאכל, עישון, צריכת אלכוהול), השמנה ותסמונת מטבולית, מצבי חולי ודלקתיות. אלו יכולים להשפיע על ביטוי גנים גם ללא שינויים בחומר התורשתי דרך השפעה על גורמי שעתוק.
מהימנות – מתייחסת למידה שבה אופן המדידה של המשתנים במחקר משקף את הערכים האמתיים של המשתנים שאותם הוא נועד למדוד, ולכן צפוי לספק תוצאות זהות בכל מדידה באופן עקבי ומדויק. מהימנות מתייחסת גם לעקביות התוצאות בין מועדים שונים, בין מעריכים/שופטים שונים, בין כלי מדידה/מבחנים שונים/חלקים שונים של אותו מבחן להערכת משתנה נתון.
תוקף – מתייחס למידה שבה כלי/אמצעי המדידה המשמש במחקר מודד את מה שהוא אמור למדוד, באופן ששולל הסברים חלופיים לתוצאות ומאפשר להסיק מסקנות חד משמעיות מן המדידה ומתוצאותיה.
תוקף פנימי – עוסק במידה שבה ההתערבות, ולא משתנים חיצוניים או מתערבים, היא שגרמה לשינוי הנצפה במשתנה הנחקר.
תוקף חיצוני – עוסק במידה שבה ניתן להכליל את התוצאות גם מחוץ לתנאי המחקר הספציפיים.
8. נספח 2 – סוגי מחקרים
מחקרי הדמייה (In silico)
מחקרי הדמיה נעזרים במחשב וכוללים סימולציות ומודלים מתמטיים ממוחשבים. בעזרת מחקרי הדמיה ניתן לבחון תוקף של תיאוריות לפני שבוחנים אותן בשיטות in vitro ו-in vivo. קיים מאגר המספק מידע מולקולרי על מבנה קולטנים (DrugBank 3.0) שניתן להיעזר בו כדי לשער כיצד ישפיעו עליהם רכיבים צמחיים שונים או תרופות. ישנם כמה מודלים המדמים השפעות של רכיבים צמחיים על אתרי קשירה, אך אלה מוגבלים עדיין.
QSAR – היא שיטת הדמיה לחיזוי רעילות של תרופות הנקראת יחסי מבנה-פעילות מדידים (Quantitative Structure-Activity Relationship models). השיטה חוקרת את הקשר בין מבנה של מולקולות ביולוגיות לבין הפעילות שלהן. מערכת המבדק QSAR מדמה תגובות של חומרים שונים עם קולטנים של אנזימי הציטוכרוֹם, עם חלבוני גליקופרוטאין P, ועם נשאים שונים. אחד היישומים המקובלים של המערכת הוא סינון ראשוני, או טרום-ראשוני, של תרופות. על פי הסינון, חומרים שהמודל ינבא להם רעילות בסבירות גבוהה לא ימשיכו להיבדק ובכך יחסכו משאבים רבים. יתרונם הנוסף הוא אי פגיעה בבעלי חיים.
יתרונות: עלות נמוכה, זמן קצר, עשויים לספק כיוונים למחקרים עתידיים.
חסרונות: מדובר במדע בראשית דרכו התלוי בהבנה מעמיקה של מנגנוני פעולה ברמת התא, מידע שלא כולו נמצא ברשותנו. המודלים מתאימים יותר להערכת ההשפעה של רכיבים צמחיים מבודדים ולא לבחינה של הצמח השלם המכיל רכיבים פעילים רבים. המודלים אינם מביאים בחשבון את ההשפעות המורכבות של מערכות הגוף השונות.
מחקרי מעבדה (in vitro)
מחקרים הנערכים בסביבה מבוקרת מחוץ לגוף החי, וכוללים שימוש באנזימים מבודדים, ברקמות מעי וכבד, בתרביות ושורות של תאים או חלקי תאים, לרוב ממקור אנושי.
דוגמאות לחומרים הנחקרים במחקרי מעבדה: רקמות, תאים מבודדים או תרביות ושורות של תאים, חלקי תאים ומקטעים של אברונים תוך תאיים: מיקרוזומים (מקטעים שבורים מהרשת האנדופלסמטית שבתוכה נוצרים חלבוני התא) של תאי כבד ומעי, ציטוזול של התאים (נוזל שהופק משבירת התאים והרצתם בצנטריפוגה) והומוגנטים (תמציות רקמה המכילות אברונים תוך תאיים שלמים). מקור הרקמות והתאים עשוי להיות בעלי חיים או בני אדם. ישנם מחקרים המשתמשים בביטוי תבניות DNA של אנזימי CYP ו-UGT המגודלות על רטרו-וירוסים, בתרביות תאים ובשורות תאים שהוחדר אליהם DNA זר (טרנספקציה), ובתאי גידולים סרטניים.
יתרונות: מחקרי מעבדה מתאימים להערכת רכיבים שונים בו זמנית, מספקים מידע תקף על מנגנוני ההשפעה הביוכימיים ולא דורשים משאבים רבים במושגי זמן וכסף. מחקרי מעבדה מספקים את המידע המדויק ביותר על האופן שבו נקשרים רכיבים צמחיים או תרופות לקולטני אנזימים ומעכבים או מפעילים אותם. כמו כן הם מאפשרים להשתמש בתאים שמקורם בבני אדם ובכך להימנע מבעיות שמקורן בהבדלים בין בעלי חיים ובני אדם.
חסרונות: רמתם של אנזימים רבים יורדת אוטומטית ברגע שהם מבודדים מהתאים והרקמות החיות. קיימים הבדלים גדולים בריכוזי התרופות או הצמחים במחקרי מעבדה בהשוואה למחקרים קליניים. העדר התייחסות לתופעות הקשורות לגוף החי כגון השפעה של מנגנוני ספיגה ופיזור, קישור לחלבונים נשאים וזמינות ביולוגית של רכיבים פעילים.
מחקרי בעלי חיים (In vivo)
מחקרים העוסקים בחקר המנגנונים המטבוליים ביונקים. הם כוללים שימוש בבעלי חיים בריאים, שימוש בבעלי חיים שהושתלו בהם גנים אנושיים, או בעלי חיים שעברו מניפולציות גנטיות כך שהתכונה הנחקרת בהם מדמה תכונה אנושית.
יתרונות: מספקים מידע רלוונטי על תגובות הדדיות בין צמחים ובין תרופות בגוף החי. בגלל שמחקרים אלו נערכים בגוף חי, הם כוללים שיקולי ספיגה, ריכוז וזמינות ביולוגית של רכיבים פעילים.
חסרונות: הבדלים מובנים בין בעלי חיים שונים ובין בני האדם, הן במנגנונים הביולוגיים השונים והן במינוני הצמחים והתרופות הדרושים לשם קבלת פעילות משמעותית.
מחקרים בקרב בני אדם:
דיווחי מקרה
מחקר תצפיתי לא התערבותי המתעד מקרה בודד. לרוב מדובר בחולה במחלה כלשהי שנטל תרופה וצמח וחווה תופעות חריגות החשודות כתוצאה של השפעה הדדית בין התרופה והצמח. המחקר מתחקה אחר השתלשלות המקרה ומעלה השערות לגבי סיבת התופעות הנצפות. כבכל המחקרים התצפיתיים המסקנות המתקבלות מניתוח הממצאים הם מתאמיות ולא מוכיחות סיבתיות ברורה. ניתן רק לשער שמשלב הצמח והתרופה גרם לתופעות הנצפות, בתנאי שנשללו גורמים אחרים שעשויים להסביר את הממצאים.
יתרונות: מציף תגובות הדדיות שייתכן שלא היו מוכרות לפני כן ומעודד חקירה שיטתית שלהן. יכול לספק תמונת מצב מהימנה על תגובות הדדיות בין צמח ובין תרופה במצב אמיתי של מחלה.
חסרונות: אנקדוטלי, עלול להוביל להערכת יתר של תופעות סינגולרית או נדירות שאינן מלמדות על כלל האוכלוסיה. כמו כן, התוקף של הממצאים המתקבלים מסוג כזה של מחקר הוא נמוך בהעדר התערבות, בקרה ויכולת שחזור (רפליקציה).
מחקרי עוקבה פרוספקטיביים
מחקר תצפיתי הבוחן קשר בין משתנים "טבעיים" ללא התערבות מתוכננת של החוקרים. במחקר פרוספקטיבי בוחנים השפעות חשיפה של אוכלוסיה לגורם כלשהו החל מנקודת זמן מסוימת ואילך ומשווים אל אוכלוסיה שלא נחשפה לאותו גורם. במחקר תצפיתי, בהעדר התערבות מבוקרת ובקרה של משתני רקע, התוצאות המתקבלות מלמדות על קשר מתאמי בלבד ולא מלמדות על סיבתיות. כך לדוגמא, אם משווים אוכלוסיה שנטלה צמח מסוים במשולב עם תרופה לאוכלוסיה שלא נטלה את הצמח במקביל לנטילת התרופה, לא ניתן לקבוע בוודאות שהתופעות הנצפות קשורות לתגובות הדדיות בין הצמח ובין התרופה, ולא לגורם נסיבתי אחר.
מחקרים קליניים פתוחים (Open label)
מחקר שבו כל הנבדקים נוטלים את התרופה או הצמח הנבדקים במחקר וחשופים למידע על סוג הטיפול הניתן להם. סוג זה של מחקרים נועד לבחינה ראשונית של השפעות תרופה או צמח על קבוצת נבדקים. במחקר זה אין בקרות של סמיות, חלוקה אקראית של נבדקים ופלסבו ולכן תוקפו נמוך בהשוואה לתוקף של מחקר מבוקר ותוצאותיו חשופות יותר להטיות.
מחקרים קליניים מבוקרים
נערכים לרוב בקרב נבדקים בריאים, ותכנונם כולל בקרות של סמיות, אקראיות ופלסבו/טיפול השוואתי (עדיפות למחקר קליני אקראי כפול סמיות ומבוקר פלסבו).במקרים רבים משתמשים במחקרים אלה בחומרים, לרוב תרופות, הידועים כנקשרים לאנזימים מסוימים (סובסטרטים), ובוחנים את השפּעת הצמחים על חילוף החומרים של החומרים הללו (רמות החומרים בדם ובשתן בשלבי התהליך השונים). "שיטת הקוקטייל" היא שימוש בכמה סובסטרטים שונים לבחינת אנזימים שונים בו זמנית.
יתרונות: מחקרים אלה מספקים את המידע הפרמקוקינטי והפרמקודינמי הרלוונטי ביותר. הם חשובים בייחוד לצורך זיהוי אוכלוסיות עם מאפיינים מיוחדים, מוטציות גנטיות של קידוד גנים המשפיעים על חילוף חומרים תרופתי.
חסרונות: חסרונם של מחקרים אלה הוא שהם יקרים, כפופים לשיקולים אתיים קפדניים, אורכים זמן רב ועלולים לא לספק מידע לגבי מנגנוני הפעולה ואופן ההשפעה על חילוף החומרים. כמו כן, כאשר המחקרים הקליניים נערכים בקרב נבדקים בריאים הם אינם מספקים לנו מידע לגבי השפּעת הפתולוגיה על חילוף החומרים.
סקירות שיטתיות ומטא אנליזות
סקירה שיטתית שמה לה למטרה לבחון את ממצאי המחקרים הקליניים הקיימים בנושא מסוים בצורה שיטתית, לסכמם ולגבש מסקנות. כל זאת, תוך צמצום הטיות בחירה ופרשנות, על ידי ניסוח א-פריורי של שאלת המחקר, קביעת אסטרטגיה לחיפוש מידע במאגרי המידע וקריטריונים להכללה ולאי הכללה של מחקרים בסקירה, והערכת תוקף של המחקרים הנכללים בסקירה על ידי הערכת הסיכון להטיה.
לעתים כוללת הסקירה השיטתית מטא אנליזה המוסיפה את המימד הכמותי למימד האיכותי של הסקירה השיטתית. מטא אנליזה היא שיטה סטטיסטית כמותית לעיבוד הממצאים שהתקבלו במחקרים לכדי נתון יחיד המסייע בגיבוש המסקנות. לרוב נתון זה הוא גודל האפקט (Effect size) המלמד על עוצמת הקשר בין המשתנים שנבדקו, והוא נמדד על פי רוב כסיכון יחסי (Relative risk, RR).
יתרונות: מסייעות בסיכום המידע הרב הקיים במאגרי המידע בצורה אמינה ומהימנה, מסייעות להעריך את התוצא (outcome) הקליני הרלוונטי ביותר, להעריך את הבעיה של מחקרים קטנים ותוצאים נדירים, להתייחס לתוקף חיצוני של מחקרים אקראיים מבוקרים, להפחית הטיה (Bias) של מחקרים אקראיים מבוקרים ספציפיים על-ידי הכללתם של כל המחקרים הרלוונטיים, ולכוון למצבים קליניים בהם יש פערים במידע ויש צורך לחקור יותר.
חסרונות: סקירה שיטתית אינה יכולה להחליף מחקר אקראי מבוקר, מתוכנן היטב ובעל גודל מדגם גדול. האיכות של המטה-אנליזה תלויה באיכות המחקרים המקוריים הכלולים בה. היא מועדת להטיית פרסום (Publication bias) שכן למשל, מחקרים בעלי תוצאות חיוביות נוטים להתפרסם יותר. ישנן שאלות קליניות שאין להן מענה במחקרים קליניים מבוקרים ואז מטא אנליזה הכוללת רק מחקרים אקראיים מבוקרים עלולה לפספס מידע קליני חשוב.
9. רשימת מקורות
- Rehman SU, Choi MS, Choe K, Yoo HH. Interactions between herbs and antidiabetics: an overview of the mechanisms, evidence, importance, and management. Arch Pharm Res. 2015 Jul;38(7):1281-98.
- Dong LF, Wu Y. (1989). Adjustment of the pH of decoctum simplex of Chinese traditional drug. Chin Pharm J 24:404–406.
- Okonta JM, Uboh M, Obonga WO. Herb-drug interaction: a case study of effect of ginger on the pharmacokinetic of metronidazole in rabbit. Indian J Pharm Sci. 2008 Mar-Apr;70(2):230-2.
- Bone K. ginger. Br. J. Phytother., 4(3):110-20, 1997.
- Brinker F. Herb Contraindications and Drug Interactions. 4th ed. Sandy (OR): Eclectic Medical Publications; 2010.
- Murata P, Kase Y, Ishige A, Sasaki H, Kurosawa S, Nakamura T. The herbal medicine Dai-kenchu-to and one of its active components [6]-shogaol increase intestinal blood flow in rats. Life Sci. 2002 Mar 15;70(17):2061-70.
- Tokita Y, Yuzurihara M, Sakaguchi M, Satoh K, Kase Y. (2007). The pharmacological effects of Daikenchuto, a traditional herbal medicine, on delayed gastrointestinal transit in rat postoperative ileus. . J. Pharmacol. Sci. 104, 303–310.
- Kawahara H, Mitani Y, Nomura M, Nose K, Yoneda A, Hasegawa T, Kubota A, Fukuzawa M. Impact of rikkunshito, an herbal medicine, on delayed gastric emptying in profoundly handicapped patients. Pediatr Surg Int. 2009 Nov; 25(11):987-90.
- Matsumura T, Arai M, Yonemitsu Y, Maruoka D, Tanaka T, Suzuki T, Yoshikawa M, Imazeki F, Yokosuka O. The traditional Japanese medicine Rikkunshito increases the plasma level of ghrelin in humans and mice. J Gastroenterol. 2010 Mar; 45(3):300-7.
- Qi QH, Wang J, Liang GG, Wu XZ. Da-Cheng-Qi-Tang promotes the recovery of gastrointestinal motility after abdominal surgery in humans. Dig Dis Sci. 2007 Jun; 52(6):1562-70.
- Fasinu PS, Bouic PJ, Rosenkranz B. An overview of the evidence and mechanisms of herb-drug interactions. Front Pharmacol. 2012 Apr 30;3:69.
- Colalto C. Herbal interactions on absorption of drugs: Mechanisms of action and clinical risk assessment. Pharmacol Res. 2010 Sep; 62(3):207-27.
- Bushra R, Aslam N, Khan AY. Food-drug interactions. Oman Med J. 2011 Mar;26(2):77-83.
- Fan L, Mao X-Q, Tao G-Y, et al. Effect of Schisandra chinensis extract and Ginkgo biloba extract on the pharmacokinetics of talinolol in healthy volunteers. Xenobiot., 39(3):249-254, 2009.
- Fan L, Zhang W, Guo D, et al. (2008). The effect of herbal medicine baicalin on pharmacokinetics of rosuvastatin, substrate of organic anion-transporting polypeptide 1B1. . Clin Pharmacol Ther 83:471–476.
- Fuchikami H, Satoh H, Tsujimoto M, Ohdo S, Ohtani H, Sawada Y. Effects of herbal extracts on the function of human organic anion-transporting polypeptide OATP-B. Drug Metab Dispos. 2006 Apr;34(4):577-82. Epub 2006 Jan 13.
- Wen F, Shi M, Bian J, Zhang H, Gui C. Identification of natural products as modulators of OATP2B1 using LC-MS/MS to quantify OATP-mediated uptake. Pharm Biol. 2016;54(2):293-302.
- Amacher, D.E.The effects of cytochrome P450 induction by xenobiotics on endobiotic metabolism in pre-clinical safety studies. Toxicology Mechanisms and Methods, 2010. 20: 159–166
- Norlin, M., and K. Wikvall. Enzymes in the conversion of cholesterol into bile acids. Current Molecular Medicine, 2007. 7: 199–218.
- Boullata, J. Natural health product interactions with medication. Nutrition in Clinical Practice 2005, 20: 33–51.
- Teyssier C, Guenot L, Suschetet M, Siess MH. Metabolism of diallyl disulfide by human liver microsomal cytochromes P-450 and flavin-containing monooxygenases. Drug Metab Dispos 1999;27:835-841.
- Tanaka E, Terada M, Misawa S. Cytochrome P450 2E1: its clinical and toxicological role. J Clin Pharm Ther 2000;25:165-175.
- Loizou GD, Cocker J. The effects of alcohol and diallyl sulphide on CYP2E1 activity in humans: a phenotyping study using chlorzoxazone. Hum Exp Toxicol 2001;20:321-327. .
- Bailey DG, Dresser G, Arnold JMO. Grapefruit–medication interactions: Forbidden fruit or avoidable consequences? CMAJ. 2013 Mar 5; 185(4): 309–316.
- Chen Y, Liu WH, Chen BL, et al. Plant polyphenol curcumin significantly affects CYP1A2 and CYP2A6 activity in healthy, male Chinese volunteers. Ann Pharmacother. Jun 2010;44(6):1038-1045.
- Tu JH, He YJ, Chen Y, Fan L, Zhang W, Tan ZR, Huang YF, Guo D, Hu DL, Wang D, Hong-Hao Zhou. Effect of glycyrrhizin on the activity of CYP3A enzyme in humans. Eur J Clin Pharmacol. 2010 Aug;66(8):805-810.
- Tu JH, Hu DL, Dai LL, et al. Effect of glycyrrhizin on CYP2C19 and CYP3A4 activity in healthy volunteers with different CYP2C19 genotypes. Xenobiotica. 2010;40(6):393–399.
- Liu J, Wang X, Cai Z, Lee FS. Effect of tanshinone IIA on the noncovalent interaction between warfarin and human serum albumin studied by electrospray ionization mass spectrometry. J Am Soc Mass Spectrom. 2008 Oct;19(10):1568-75.
- Bhardwaj RK, Glaeser H, Becquemont L, et al. Piperine, a major constituent of black pepper, inhibits human P-glycoprotein and CYP3A4. J Pharmacol Exp Ther 2002;302:645-650.
- Kim S-W, Kwon HY, Chi D-W, et al. Reversal of P-glycoprotein-mediated multidrug resistance by ginsenoside Rg(3). Biochem Pharmacol 2003;65:75-82.
- Choi C-H, Kang G, Min Y-D. Reversal of P-glycoprotein-mediated multidrug resistance by protopanaxatriol ginsenosides from Korean red ginseng. Planta Med 2003;69:235-240.
- Zhang S, Morris ME. Effects of the flavonoids biochanin A, morin, phloretin, and silymarin on P-glycoprotein-mediated transport. J Pharmacol Exp Ther 2003;304:1258-1267.
- Effects of dietary chemopreventive phytochemicals on P-glycoprotein function. . Nabekura T, Kamiyama S, Kitagawa S. . Biochem Biophys Res Commun 2005;327:866-870.
- Romiti N, Tongiani R, Cervelli F, et al. Effects of curcumin on P-glycoprotein in primary cultures of rat hepatocytes. Life Sci 1998;62:2349-2358.
- Limtrakul P, Anuchapreeda S, Buddhasukh D. Modulation of human multidrug-resistance MDR-1 gene by natural curcuminoids. BMC Cancer 2004;4:13.
- Sadzuka Y, Sugiyama T, Sonobe T. Efficacies of tea components on doxorubicin induced antitumor activity and reversal of multidrug resistance. Toxicol Lett 2000;114:155-162.
- Jodoin J, Demeule M, Beliveau R. Inhibition of the multidrug resistance P-glycoprotein activity by green tea polyphenols. Biochim Biophys Acta 2002;1542:149-159.
- Mei Y, Qian F, Wei D, et al. Reversal of cancer multidrug resistance by green tea polyphenols. J Pharm Pharmacol 2004;56:1307-1314.
- Xu J, Go ML, Lim L-Y. Modulation of digoxin transport across Caco-2 cell monolayers by citrus fruit juices: Lime, lemon, grapefruit, and pummelo. Pharm Res 2003;20:169-176 : s.n.
- Ikegawa T, Ushigome F, Koyabu N, et al. Inhibition of P-glycoprotein by orange juice components, polymethoxyflavones in adriamycin-resistant human myelogenous leukemia (K562/ADM) cells. Cancer Lett 2000;160:21-28.
- Takanaga H, Ohnishi A, Yamada S, et al. Polymethoxylated flavones in orange juice are inhibitors of P-glycoprotein but not cytochrome P450 3A4. J Pharmacol Epr Ther 2000; 293: 230-236.
- Honda Y, Ushigome F, Koyabu N, et al. Effects of grapefruit juice and orange juice components on P-glycoprotein- and MRP2-mediated drug efflux. Br J Pharmacol 2004;143:856-864.
- Ozkarsli M, Sevim H, Sen A. In vivo effects of Urtica urens (dwarf nettle) on the expression of CYP1A in control and 3-methylcholanthrene-exposed rats. Xenobiotica. 2008 Jan;38(1):48-61.
- Maliakal PP, Wanwimolrum S. Effect of herbal teas on hepatic drug metabolizing enzymes in rats. J. Pharm. Pharmacol., 53:1323-1329, 2001.
- Iqbal M., Sharma S. D., Okazaki Y., Fujisawa M., Okada S. Dietary supplementation of curcumin enhances antioxidant and phase II metabolizing enzymes in ddY male mice: possible role in protection against chemical carcinogenesis and toxicity. Pharmacol. Toxicol. 2003, 92, 33–38.
- Alkharfy KM, Frye RF. Effect of valerian, valerian/hops extracts, and valerenic acid on glucuronidation in vitro. Xenobiotica. 2007 Feb; 37(2):113-23.
- Mohamed M. E., Frye R. F. Inhibition of intestinal and hepatic glucuronidation of mycophenolic acid by Ginkgo biloba extract and flavonoids. Drug Metab. Dispos. 2010, 38, 270–275.
- Liu C, Cao YF, Fang ZZ, et al. Strong inhibition of deoxyschizandrin and schisantherin A toward UDP-glucuronosyltransferase (UGT) 1A3 indicating UGT inhibition-based herb–drug interaction. Fitoterapia, 2012b. 83:1415–1419.
- Ueng YF, Shyu CC, Lin YL, et al. Effects of baicalein and wogonin on drug-metabolizing enzymes in C57BL/6J mice. Life Sci, 2000. 67:2189–2200.
- Fasinu PS, Gutmann H, Schiller H, James AD, Bouic PJ, Rosenkranz B. The potential of Sutherlandia frutescens for herb-drug interaction.Drug Metab Dispos. 2013 Feb;41(2):488-97.
- Song IS, Kong TY, Jeong HU, Kim EN, Kwon SS, Kang HE, Choi SZ, Son M, Lee HS. Evaluation of the transporter-mediated herb-drug interaction potential of DA-9801, a standardized dioscorea extract for diabetic neuropathy, in human in vitro and rat in vivo. BMC Complement Altern Med. 2014 Jul 17; 14:251 : s.n.
- Bihl G., Meyers A. Recurrent renal stone disease – advances in pathogenesis and clinical management. Lancet, 2001. 358, 651–656.
- Sheena M, Ajith A, Janardhanan K. Prevention of nephrotoxicity induced by the anticancer drug Cisplatin, using Ganoderma lucidum, a medicinal mushroom occuring in South India. Curr Sci. 2003;85:478–82.
- Izzo AA. Herb-drug interactions: An overview of the clinical evidence. Fundam Clin Pharmacol (2005) 19:1–16.
- Zhou S, Gao Y, Jiang W, Huang M, Xu A, Paxton JW. Interactions of herbs with cytochrome P450. Drug Metab Rev. 2003;35:35–98.
- Zhou S, Koh HL, Gao Y, Gong ZY, Lee EJ. Herbal bioactivation: the good, the bad and the ugly. Life Sci. 2004;74:935–968.
- Piscitelli SC, Burstein AH, Welden N et al. The effect of garlic supplements on the pharmacokinetics of saquinavir. Clin Infect Dis 2002;34:234-238.
- Yoshioka M, Ohnishi N, Koishi T, et al. Studies on interactions between functional foods or dietary supplements and medicines. IV. Effects of Ginkgo biloba leaf extract on the pharmacokinetics and pharmacodynamics of nifedipine in healthy volunteers. Biol. Pharm. Bull., 27(12):2006-2009, 2004.
- Ohnishi N, Kusuhara M, Yoshioka M, et al. Studies on interactions between functional foods or dietary supplements and medicines. I. Effects of Ginkgo biloba leaf 22 extract on the pharmacokinetics of diltiazem in rats. Biol Pharm Bull (2003).26:1315–1320.
- Wang W, Javors M, Blodgett J, et al. Effect of Ginkgo Supplement on the Pharmacokinetics of Pioglitazone in Healthy Subjects. Diabetes. 2007;56(Suppl 1):A560.
- Shinozuka K, Umegaki K, Kubota Y, et al. Feeding of Ginkgo biloba extract (GBE) enhances gene expression of hepatic cytochrome P-450 and attenuates the hypotensive effect of nicardipine in rats. Life Sci (2002). 70:2783–2792.
- Kubota Y, Kobayashi K, Tanaka N, et al. Pretreatment with Ginkgo biloba extract weakens the hypnosis action of phenobarbital and its plasma concentration in rats. J Pharm Pharmacol (2004).56:401–405.
- Gurley BJ, Swain A, Williams DK, et al. Gauging the clinical significance of P-glycoprotein-mediated herb- drug ineractions: Comparative effects of St. John's wort, echinacea, clarithromycin, and rifampin on digoxin pharmacokinetics. Mol. Nut. Food Res., .
- Mueller SC, Uehleke B, Woehling H, et al. Effect of St John's wort dose and preparations on the pharmacokinetics of digoxin. Clin. Pharmacol. Ther., 75(6):546-557, 2004.
- Francesca Borrelli, Angelo A. Izzo. Herb–Drug Interactions with St John’s Wort (Hypericum perforatum): an Update on Clinical Observations. AAPS J. 2009 Dec; 11(4): 710. Published online 2009 Oct 27.
- Arold G, Donath F, Maurer A, Diefenbach K, Bauer S, Henneicke-von Zepelin HH, Friede M, Roots I. No relevant interaction with alprazolam, caffeine, tolbutamide, and digoxin by treatment with a low-hyperforin St John’s wort extract. Planta Med. 2005;71:331.
- Lau WC, Gurbel PA, Carville DG, et al. J Am Coll Cardiol. 2007;49(9, Suppl 1):343A–344A.
- Lau WC, Welch TD, Shields TA, et al. J Am Coll Cardiol. 2010;55(10, Suppl 1):A171. [E1600].
- Kwatra D, Venugopal A, Standing D, et al. Bitter melon extracts enhance the activity of chemotherapeutic agents through the modulation of multiple drug resistance. J Pharm Sci. 2013 Dec;102(12):4444-54.
- Somasagara RR, Deep G, Shrotriya S, Patel M, Agarwal C, Agarwal R. B. Bitter melon juice targets molecular mechanisms underlying gemcitabine resistance in pancreatic cancer cells. Int J Oncol. 2015 Apr;46(4):1849-57. Epub 2015 Feb 9.
- Tumorigenicity and Overcomes Cisplatin-Resistance in Ovarian Cancer Cells Through Targeting AMPK Signaling Cascade. . Integr Cancer Ther. 201.
- Limtrakul P, Khantamat O, Pintha K .Inhibition of P-glycoprotein activity and reversal of cancer multidrug resistance by Momordica charantia extract. Cancer Chemother Pharmacol. 2004 Dec;54(6):525-30.
- Plouzek CA, Ciolino HP, Clarke R, et al. Inhibition of P-glycoprotein activity and reversal of multidrug resistance in vitro by rosemary extract. Eur. J. Canc., 35(10):1541-1545, 1999.
- Takahashi T, Kaku T, Sato T, et al. Effects of Acanthopanax senticosus HARMS extract on drug transport in human intestinal cell line Caco-2. . J Nat Med (2010). 64:55–62.
- Yu CP, Hsieh YC, Shia CS, Hsu PW, Chen JY, Hou YC, Hsieh YW. Increased Systemic Exposure of Methotrexate by a Polyphenol-Rich Herb via Modulation on Efflux Transporters Multidrug Resistance-Associated Protein 2 and Breast Cancer Resistance Protein. J Pharm Sci. 2016 Jan;105(1):343-9. .
- Tan KW, Cooney J, Jensen D, Li Y, Paxton JW, Birch NP, Scheepens A. Hop-derived prenylflavonoids are substrates and inhibitors of the efflux transporter breast cancer resistance protein (BCRP/ABCG2). Mol Nutr Food Res. 2014 Nov;58(11):2099-110. : s.n.
- He JX, Akao T, Tani T. (2003). Influence of co-administered antibiotics on the pharmacokinetic fate in rats of paeoniflorin and its active metabolite paeonimetabolin-I from Shaoyao-Gancao-tang. J Pharm Pharmacol 55:313–321.
- Ma BL, Ma YM, Shi R, et al. Identification of the toxic constituents in Rhizoma Coptidis. J Ethnopharmacol (2010).128:357–364.
- Greenblatt DJ, von Moltke LL. Interaction of warfarin with drugs, natural substances, and foods. J Clin Pharmacol. 2005 Feb;45(2):127-32. Review.
- Dannawi M. Possible serotonin syndrome after combination of buspirone and St John's Wort. J Psychopharmacol. 2002 Dec;16(4):401.
- Olukoga A, Donaldson D. J R Soc Health. Liquorice and its health implications. 2000;120(2):83–89. .
- Hanai H, Iida T, Takeuchi K, et al. Curcumin maintenance therapy for ulcerative colitis: randomized, multicenter, double-blind, placebo-controlled trial. Clin. Gastroenterol. Hepatol., 4(12):1502-1506, 2006.
- Lang A, Salomon N, Wu JC, Kopylov U, Lahat A, Har-Noy O, Ching JY, Cheong PK, Avidan B, Gamus D, Kaimakliotis I, Eliakim R, Ng SC, Ben-Horin S. Curcumin in Combination With Mesalamine Induces Remission in Patients With Mild-to-Moderate Ulcerative Colitisin in a Randomized Controlled Trial. Clin Gastroenterol Hepatol. 2015 Feb 24. [Epub ahead of print].
- Holt PR, Katz S, Kirshoff R. Curcumin therapy in inflammatory bowel disease: a pilot study. Dig. Dis. Sci., 50(11):2191-2193, 2005.
- Chandran B, Goel A. A randomized, pilot study to assess the efficacy and safety of curcumin in patients with active rheumatoid arthritis. Phyother. Res., 26:1719-1725, 2012.
- Baskaran K, Kizar Ahamath B, Radha Shanmugasundaram K, et al. Antidiabetic effect of a leaf extract from Gymnema sylvestre in non-insulin-dependent diabetes mellitus patients. J. Ethnopharm., 30:295-305, 1990.
- Shanmugasundaram ERB, Rajeswari G, Baskaran K, et al. Use of Gymnema sylvestre leaf extract in the control of blood glucose in insulin-dependent diabetes mellitus. J. Ethnopharm., 30:281-294, 1990.
- J Birks, J Grimley Evans. Ginkgo biloba for cognitive impairment and dementia. Cochrane Database of Systematic Reviews 2007, Issue 2. Art. No.: CD003120.
- Spiteri-Staines, S. Herbal medicines: adverse effects and drug-herb interactions. Journal of the Malta College of Pharmacy Practice, 17, 2011.
- Williamson EM. Drug interactions between herbal medicines and prescription medicines. Drug Safety.2003;26(15):1075-1092. .
- Scott GN, Elmer GW. Update on Natural Product-Drug Interactions. Am J Health-Syst Pharm.2002;59(4):339-347.
- Rees WDW, Rhodes J, Wright JE, et al. Effect of deglycyrrhizinated liquorice on gastric mucosal damage by aspirin. Scand. J. Gastroent., 14:605-607, 1979.
- Dehpour AR, Zolfaghari ME, Samadian T, et al. The protective effect of liquorice components and their derivatives against gastric ulcer induced by aspirin in rats. . J. Pharm. Pharmacol., 46:148-149, 1994.
- Morgan AG, McAdam WAF, Pacsoo C, et al. Comparison between cimetidine and Caved-S in the treatment of gastric ulceration, and subsequent maintenance therapy. Gut, 23:545-551, 1982.
- Dehpour AR, Zolfaghari ME, Samadian T, et al. Antiulcer activities of liquorice and its derivatives in experimental gastric lesion induced by ibuprofen in rats. Int. J. Pharmaceut., 119:133-138, 1995.
- Yi SY, Nan KJ, Chen SJ. Effect of extract of Ginkgo biloba on doxorubicin-associated cardiotoxicity in patients with breast cancer. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2008 Jan;28(1):68-70.
- Biswal BM, Sulaiman SA, Ismail HC, Zakaria H, Musa KI. Effect of Withania somnifera (ashwagandha) on the development of chemotherapy-induced fatigue and quality of life in breast cancer patients. Integr Cancer Ther. 2013 Jul;12(4):312-22. Epub 2012 Nov 9.
- Barton DL, Soori GS, Bauer BA, et al. Pilot study of Panax quinquefolius (American ginseng) to improve cancer-related fatigue: a randomized, double-blind, dose-finding evaluation: NCCTG trial N03CA. Support. Care Cancer, 18:179-187, 2010.
- Jacobson JS, Grann VR, et al. Randomized trial of black cohosh for the treatment of hot flashes among women with a history of breast cancer. J Clin Oncol. 2001 May 15;19(10):2739-45.
- Jin X, Ruiz Beguerie J, Sze DM, Chan GC. Ganoderma lucidum (Reishi mushroom) for cancer treatment. Cochrane Database Syst Rev. 2016 Apr 5;4:CD007731. .
- Ladas EJ, Kroll DJ, Oberlies NH, Cheng B, Ndao DH, Rheingold SR, Kelly KM. A randomized, controlled, double-blind, pilot study of milk thistle for the treatment of hepatotoxicity in childhood acute lymphoblastic leukemia (ALL). Cancer. 2010 Jan 15;116(2):506-13.
- Zhang S, Pan H, Peng X, Lu H, Fan H, Zheng X, Xu G, Wang M, Wang J. Preventive use of a hepatoprotectant against anti-tuberculosis drug-induced liver injury: A randomized controlled trial. J Gastroenterol Hepatol. 2016 Feb;31(2):409-16.
- Chen J-T, Tominaga K, Sato Y, et al. Maitake mushroom (Grifola frondosa) extract induces ovulation in patients with polycystic ovary syndrome: a possible monotherapy and a combination therapy after failure with first-line clomiphene citrate. . J. Altern. Compl. Med., 16(12):1-5, 2010.
- Shao X, Ai N, Xu D, Fan X. Exploring the interaction between Salvia miltiorrhiza and human serum albumin: Insights from herb-drug interaction reports, computational analysis and experimental studies. Spectrochim Acta A Mol Biomol Spectrosc. 2016 May 15;161:1-7.
- Mohutsky MA, Anderson GD, Miller JW, Elmer GW. Ginkgo biloba: evaluation of CYP2C9 drug interactions in vitro and in vivo. Am J Ther. 2006;13:24–31.
- Budzinski JW, Trudeau VL, Drouin CE, Panahi M, Arnason JT, Foster BC. Modulation of human cytochrome P450 3A4 (CYP3A4) and P-glycoprotein (P-gp) in Caco-2 cell monolayers by selected commercial-source milk thistle and goldenseal products. Can J Physiol Pharmacol, 2007, 85:966–978.
- Obach RS. Inhibition of human cytochrome P450 enzymes by constituents of St. John’s wort, an herbal preparation used in the treatment of depression. J.Pharm. Exp. Ther., 294(1):88-95, 2000.
- Roby CA, Anderson GD, Kantor E et al. St John’s wort: effect on CYP3A4 activity. Clin Pharmacol Ther 2000;67:451-457.
- Mooiman KD, Goey AK, Huijbregts TJ, Maas-Bakker RF, Beijnen JH, Schellens JH, Meijerman I. The in-vitro effect of complementary and alternative medicines on cytochrome P450 2C9 activity. J Pharm Pharmacol. 2014 Sep;66(9):1339-46. .
- Etheridge AS, Black SR, Patel PR, So J, Mathews JM. An in vitro evaluation of cytochrome P450 inhibition and P-glycoprotein interaction with goldenseal, Ginkgo biloba, grape seed, milk thistle, and ginseng extracts and their constituents. Planta Med. 2007 Jul; 73(8):731-41.
- Venkataramanan R, Ramachandran V, Komoroski BJ, Zhang S, Schiff PL, Strom SC. Milk thistle, a herbal supplement, decreases the activity of CYP3A4 and uridine diphosphoglucuronosyl transferase in human hepatocyte cultures. Drug Metab Dispos. 2000 Nov; 28(11):1270-3.
- van Erp NP, Baker SD, Zhao M, Rudek MA, Guchelaar HJ, Nortier JW, Sparreboom A, Gelderblom H. Effect of milk thistle (Silybum marianum) on the pharmacokinetics of irinotecan. Clin Cancer Res. 2005 Nov 1; 11(21):7800-6.
- Gurley BJ, Swain A, Hubbard MA, Williams DK, Barone G, Hartsfield F, Tong Y, Carrier DJ, Cheboyina S, Battu SK. Clinical assessment of CYP2D6-mediated herb-drug interactions in humans: effects of milk thistle, black cohosh, goldenseal, kava kava, St. John's wort and Echinacea. Mol Nutr Food Res. 2008 Jul; 52(7):755-63. : s.n.
- Gurley B, Hubbard MA, Williams DK, Thaden J, Tong Y, Gentry WB, Breen P, Carrier DJ, Cheboyina S. Assessing the clinical significance of botanical supplementation on human cytochrome P450 3A activity: comparison of a milk thistle and black cohosh product to rifampin and clarithromycin. J Clin Pharmacol. 2006 Feb; 46(2):201-13. : s.n.
- Gurley BJ, Gardner SF, Hubbard MA, Williams DK, Gentry WB, Carrier J, Khan IA, Edwards DJ, Shah A. In vivo assessment of botanical supplementation on human cytochrome P450 phenotypes: Citrus aurantium, Echinacea purpurea, milk thistle, and saw palmetto.
- Brantley SJ, Argikar AA, Lin YS, Nagar S, Paine MF. Herb–Drug Interactions: Challenges and Opportunities for Improved Predictions. Drug Metab Dispos. 2014 Mar; 42(3): 301–317.
- Shanks N, Greek R, Greek J. Are animal models predictive for humans? Philos Ethics Humanit Med. 2009 Jan 15;4:2.
- Chatterjee SS, Doelman CJ, Noldner M, et al. (2005). Influence of the Ginkgo extract EGb 761 on rat liver cytochrome P450 and steroid metabolism and excretion in rats and man. . J Pharm Pharmacol 57:641–650.
- Gurley BJ, Gardner SF, Hubbard MA et al. Clinical assessment of effects of botanical supplementation on cytochrome P450 phenotypes in the elderly: St John’s wort, garlic oil, Panax ginseng and Ginkgo biloba. Drugs Aging 2005.
- Gurley BJ, Gardner SF, Hubbard MA et al. Cytochrome P450 phenotypic ratios for predicting herb-drug interactions in humans. Clin Pharmacol Ther 2002.
- Uchida S, Yamada H, Li XD, et al. Effects of Ginkgo biloba extract on pharmacokinetics and pharmacodynamics of tolbutamide and midazolam in healthy volunteers. J. Clin. Pharmacol., 46:1290- 1298, 2006.
- Robertson SM, Davey RT, Voell J, et al. Effect of Ginkgo biloba extract on lopinavir, midazolam and fexofenadine pharmacokinetics in health subjects. Curr. Med. Res. Opion., 24(2):591-599, 2008.
- Bracken MB. Why animal studies are often poor predictors of human reactions to exposure. J R Soc Med. 2009 Mar 1; 102(3): 120–122.
- Miroddi M, Calapai G, Navarra M, Minciullo PL, Gangemi S. Passiflora incarnata L.: ethnopharmacology, clinical application, safety and evaluation of clinical trials. J Ethnopharmacol. 2013 Dec 12;150(3):791-804. Epub 2013 Oct 17.
- Fisher AA, Purcell P, Le Couteur DG. Toxicity of Passiflora incarnata L. Journal of Toxicology. Clinical Toxicology, 2000, 38:63–66.
- Mills S. Bone K. Principles and practice of Phytotherapy. Modern Herbal Medicine, 2ed. : s.n., Churchill Livingstone, 2013.
- Tong X, Xiao D, Yao F, Huang T. Astragalus membranaceus as a cause of increased CA19-9 and liver and kidney cysts: a case report. J Clin Pharm Ther. 2014 Oct;39(5):561-3. Epub 2014 May 8.
- Zhang ZJ, Tan QR, Tong Y, Wang XY, Wang HH, Ho LM, Wong HK, Feng YB, Wang D, Ng R, McAlonan GM, Wang CY, Wong VT. An epidemiological study of concomitant use of Chinese medicine and antipsychotics in schizophrenic patients: implication for herb-drug interaction. PLoS One. 2011 Feb 16;6(2):e17239. .
- Warnock M, McBean D, Suter A, et al. Effectiveness and safety of devil‟s claw tablets in patients with general rheumatic disorders. Phytother. Res., 21:1228-1233, 2007.
- Chantre P, Cappelaere A, Leblan D, et al. Efficacy and tolerance of Harpagophytum procumbens versus diacerhein in treatment of osteoarthritis. Phytomed., 7(3):177-183, 2000.
- Izzo AA,Hoon-Kim S., Radhakrishnan R., Williamson EM. A Critical Approach to Evaluating Clinical Efficacy, Adverse Events and Drug Interactions of Herbal Remedies,. Phytotheraphy research, 2016; 30(5):691-700.
- Karsch-Völk M, Barrett B, Kiefer D, Bauer R, Ardjomand-Woelkart K, Linde K. Echinacea for preventing and treating the common cold. Cochrane Database Syst Rev. 2014 Feb 20;(2):CD000530.
- Chiang HM, Chao PD, Hsiu SL, et al. ginger significantly decreased the oral bioavailability of cyclosporine in rats. . Am J Chin Med (2006).34:845–855.
- Hellum BH, Hu Z, Nilsen OG. Trade herbal products and induction of CYP2C19 and CYP2E1 in cultured human hepatocytes. Basic Clin Pharmacol Toxicol. 2009 Jul;105(1):58-63.
- Lai L, Hao H, Wang Q, et al. Effects of short-term and long-term pretreatment of Schisandra lignans on regulating hepatic and intestinal CYP3A in rats. Drug Metab Dispos (2009). 37:2399–2407.
- Yale SH, Glurich I. Analysis of the inhibitory potential of Ginkgo biloba, Echinacea purpurea, and Serenoa repens on the metabolic activity of cytochrome P450 3A4, 2D6, and 2C9. . J Altern Complement Med. 2005 Jun;11(3):433-9. s.n., J Altern Complement Med 11:433–439.
- Hao M, Zhao Y, Chen P, et al. Structure–activity relationship and substrate-dependent phenomena in effects of ginsenosides on activities of drug-metabolizing P450 enzymes. PLoS One (2008). 3:e2697.
- Zhong XK, Li DC, Jiang JG. Identification and quality control of Chinese medicine based on the fingerprint techniques. Curr Med Chem (2009).16:3064–3075.
- Chang WT, Thissen U, Ehlert KA, et al.. Effects of growth conditions and processing on Rehmannia glutinosa using fingerprint strategy. Planta Med (2006b) 72:458–467.
- Induction of cytochrome P450-dependent monooxygenase by extracts of the medicinal herb Salvia miltiorrhiza. . Kuo YH, Lin YL, Don MJ, et al. (2006). J Pharm Pharmacol 58:521–527.
- Yin OQP, Tomlinson B, Waye MMY, Chow AHL, Chow MSS. Pharmacogenetics and herb-drug interactions: experience with Ginkgo biloba and omeprazole. Pharmacogenetics. 2004;14:841–850.
- Butterweck V, Derendorf H, Gaus W, et al. Pharmacokinetic herb-drug interactions: Are preventive screenings necessary and appropriate?. Planta Med (2004) 70:784–791.
- Noh K, Kang Y, Nepal MR, Jeong KS, Oh do G, Kang MJ, Lee S, Kang W, Jeong HG, Jeong TC. Role of Intestinal Microbiota in Baicalin-Induced Drug Interaction and Its Pharmacokinetics. Molecules. 2016 Mar 10;21(3):337.
- Hong T, Zhang M, Fan J. Cordyceps sinensis (a traditional Chinese medicine) for kidney transplant recipients. Cochrane Database Syst Rev. 2015 Oct 12;10:CD009698.
- Dasgupta A, Wu S, Actor J et al. Effect of Asian and Siberian ginseng on serum digoxin measurement by five digoxin immunoassays: significant variation in digoxin-like immunoreactivity among commercial ginsengs. Am J Clin Pathol 2003;119:298-303.
- Dasgupta A, Reyes MA. Effect of Brazilian, Indian, Siberian, Asian, and North American ginseng on serum digoxin measurement by immunoassays and binding of digoxin-like immunoreactive components of ginseng with Fab fragments of antidigoxin antibody (Digibind). Am. J. Clin. Pathol. 124:229-236, 2005.
- Alsanad SM, Williamson EM, Howard RL.Cancer patients at risk of herb/food supplement-drug interactions: a systematic review. Phytother Res. 2014 Dec;28(12):1749-55.
- Li J, Gödecke T, Chen SN, et al. In vitro metabolic interactions between black cohosh (Cimicifuga racemosa) and tamoxifen via inhibition of cytochromes P450 2D6 and 3A4. Xenobiotica.2011 Aug 9. [Epub ahead of print].
- Hernández Muñoz G, Pluchino S. Cimicifuga racemosa for the treatment of hot flushes in women surviving breast cancer. . Maturitas. 2003 Mar 14;44 Suppl 1:S59-65.
- Rostock M, Bartsch HH, et al. Black cohosh (Cimicifuga racemosa) in tamoxifen-treated breast cancer patients with climacteric complaints - a prospective observational study. Gynecol Endocrinol. 2011 Oct;27(10):844-8.
- Nisslein T, Freudenstein J. Coadministration of the aromatase inhibitor formestane and an isopropanolic extract of black cohosh in a rat model of chemically induced mammary carcinoma. Planta Med. 2007 Apr;73(4):318-22. Epub 2007 Mar 12.
- Einbond LS, Soffritti M, Degli Esposti D, Tibaldi E, Lauriola M, Bua L, He K, Genovese G, Su T, Huggins L, Wang X,Roller M, Wu HA. Chemopreventive potential of black cohosh on breast cancer in Sprague-Dawley rats. Anticancer Res. 2012 Jan;32(1):21-30.
- Bodinet C, Freudenstein J. Influence of Cimicifuga racemosa on the proliferation of estrogen receptor-positive human breast cancer cells. Breast Cancer Res Treat. 2002 Nov;76(1):1-10.
- Al-Akoum M, Dodin S, Akoum A. Synergistic cytotoxic effects of tamoxifen and black cohosh on MCF-7 and MDA-MB-231 human breast cancer cells: an in vitro study. Can J Physiol Pharmacol. 2007 Nov;85(11):1153-9.
- Einbond LS, Shimizu M, Nuntanakorn P, Seter C, Cheng R, Jiang B, Kronenberg F, Kennelly EJ, Weinstein IB. Actein and a fraction of black cohosh potentiate antiproliferative effects of chemotherapy agents on human breast cancer cells. Planta Med. 2006 Oct; 72(13):1200-6. : s.n.
- Gorman GS, Coward L, Darby A, Rasberry B. Effects of herbal supplements on the bioactivation of chemotherapeutic agents. J Pharm Pharmacol. 2013 Jul;65(7):1014-25. .
- Ben-Arye E, Samuels N, Goldstein LH, Mutafoglu K, Omran S, Schiff E, Charalambous H, Dweikat T, Ghrayeb I, Bar-Sela G, Turker I, Hassan A, Hassan E, Saad B, Nimri O, Kebudi R, Silbermann M0. Potential risks associated with traditional herbal medicine use in cancer care: A study of Middle Eastern oncology health care professionals. Cancer. 2016 Feb 15;122(4):598-610.
- Etheridge AS, Kroll DJ, Mathews JM. Inhibition of paclitaxel metabolism in vitro in human hepatocytes by Ginkgo biloba preparations. J Diet Suppl. 2009;6(2):104-10.
- Hamoud S, Hayek T, Volkova N, Attias J, Moscoviz D, Rosenblat M, Aviram M.Pomegranate extract (POMx) decreases the atherogenicity of serum and of human monocyte-derived macrophages (HMDM) in simvastatin-treated hypercholesterolemic patients: a double-blinded, placebo-controlled, randomized, prospective pilot study. Atherosclerosis. 2014 Jan;232(1):204-10.
- Aviram M, Rosenblat M, Gaitini D, Nitecki S, Hoffman A, Dornfeld L, et al. Pomegranate juice consumption for 3 years by patients with carotid artery stenosis reduces common carotid intima-media thickness, blood pressure and LDL oxidation. Clin Nutr. 2004;23:423–33. .
- Mirmiran P, Fazeli MR, Asghari G, Shafiee A, Azizi F. Effect of pomegranate seed oil on hyperlipidaemic subjects: A double-blind placebo-controlled clinical trial. Br J Nutr. 2010;104:402–6.
- Aviram M, Dornfeld L, Rosenblat M, Volkova N, Kaplan M, Coleman R, Hayek T, Presser D, Fuhrman B. Pomegranate juice consumption reduces oxidative stress, atherogenic modifications to LDL, and platelet aggregation: studies in humans and in atherosclerotic apolipoprotein E-deficient mice. Am J Clin Nutr. 2000 May; 71(5):1062-76.
- Esmaillzadeh A, Tahbaz F, Gaieni I, Alavi-Majd H, Azadbakht L. Cholesterol-lowering effect of concentrated pomegranate juice consumption in type II diabetic patients with hyperlipidemia. Int J Vitam Nutr Res. 2006 May; 76(3):147-51.
- Kaplan M, Hayek T, Raz A, Coleman R, Dornfeld L, Vaya J, Aviram M. Pomegranate juice supplementation to atherosclerotic mice reduces macrophage lipid peroxidation, cellular cholesterol accumulation and development of atherosclerosis. J Nutr. 2001 Aug; 131(8):2082-9.
- de Nigris F, Williams-Ignarro S, Sica V, Lerman LO, D'Armiento FP, Byrns RE, Casamassimi A, Carpentiero D, Schiano C, Sumi D, Fiorito C, Ignarro LJ, Napoli C. Effects of a pomegranate fruit extract rich in punicalagin on oxidation-sensitive genes and eNOS activity at sites of perturbed shear stress and atherogenesis. Cardiovasc Res. 2007 Jan 15; 73(2):414-23.
- Gui QF, Xu ZR, Xu KY, Yang YM. The Efficacy of Ginseng-Related Therapies in Type 2 Diabetes Mellitus: An Updated Systematic Review and Meta-analysis. Medicine (Baltimore). 2016 Feb;95(6):e2584.
- Vuksan V, Sung M-K, Sievenpiper JL, Stavro PM, Jenkins AL, Di Buono M, Lee KS, Leiter LA, Nam KY, Arnason JT, Choi M, Naeem A. Korean red ginseng (Panax ginseng) improves glucose and insulin regulation in well-controlled, type 2 diabetes: results of a randomized, double-blind, placebo-controlled study of efficacy and safety. Nutr. Metab. Cardiovasc. Dis., (in press July, 2006).
- Ma SW, Benzie IF, Chu TT, Fok BS, Tomlinson B, Critchley LA. Effect of Panax ginseng supplementation on biomarkers of glucose tolerance, antioxidant status and oxidative stress in type 2 diabetic subjects: results of a placebo-controlled human intervention trial. Diabetes Obes Metab. 2008;10(11):1125–1127.
- Okuda H, Yoshida R.Proceedings of the Third International Ginseng Symposium.Seoul, Korea: Korea Ginseng Research Institute; 1980. pp. 53–57.
- Belcaro G, Cesarone MR, Dugall M, et al. Product-evaluation registry of Meriva®, a curcumin-phosphatidylchole complex, for the complementary management of osteoarthritis. Panminerva Med., 52(2 Suppl 1):55-62, 2010
- Belcaro G, Cesarone MR, Dugall M, et al. Efficacy and safety of Meriva®, a curcumin-phosphatidylcholine complex, during extended administration in osteoarthritis patients. Altern. Med. Rev., 15(4):337-344, 2010
- Ramos-Esquivel A, Víquez-Jaikel Á, Fernández C. Potential Drug-Drug and Herb-Drug Interactions in Patients With Cancer: A Prospective Study of Medication Surveillance. J Oncol Pract. 2017 Jun 19:JOP2017020859.
https://www.ncbi.nlm.nih.gov/pubmed/28628392





